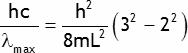Énoncé
Le butadiène CH2=CH-CH=CH2 est une molécule possédant 4 électrons π délocalisés. Montrer qu'un modèle de la molécule où ces électrons se comportent comme des particules dans une boite de longueur 5.8 Å permet d'expliquer que la longueur d'onde la plus grande du spectre d'absorption du butadiène dans l'UV se trouve à 217 nm (il faut noter que chaque fonction d'onde ne peut décrire les propriétés de plus de 2 électrons).
Réponse
L'énergie d'une particule placée dans une boite unidimensionnelle est quantifiée selon:
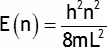
où m est la masse d'une particule (ici un électron) et L est la longueur de la boite (ici 5.8 Å).
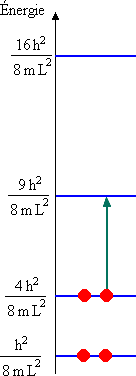
Puisque chaque fonction d'onde ne peut décrire les propriétés de plus de 2 électrons, seulement deux électrons possèdent l'énergie la plus basse permise, E(n=1). Les deux autres possèdent une énergie E(n=2). Ces électrons peuvent atteindre des états de plus grande énergie (des états excités) en absorbant par exemple l'énergie h ν d'une onde électromagnétique si:
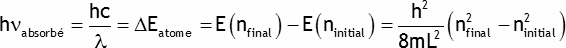
La longueur d'onde la plus grande du spectre d'absorption correspond à la transition de ni = 2 à nf = 3:
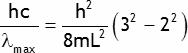
ce qui conduit à λmax = 222 nm, en très bon accord avec la valeur expérimentale.

![]()
![]()