
Énoncé
Les orbitales de l'atome d'hydrogène sont décrites par trois nombres quantiques: n, l et m.
- Si n = 2 et m = -1, quelles sont toutes les valeurs possibles de l ?
- Si n = 2 et m = 0, quelles sont toutes les valeurs possibles de l ?
- Si l = 2 et n = 3, quelles sont toutes les valeurs possibles de m ?
- Si l = 0 et n = 5, quelles sont toutes les valeurs possibles de m ?
- Si m = 1 et l = 1, quelles sont toutes les valeurs possibles de n ?
Réponse
Toutes les valeurs possibles des nombres quantiques, pour n jusqu'à 4, sont:
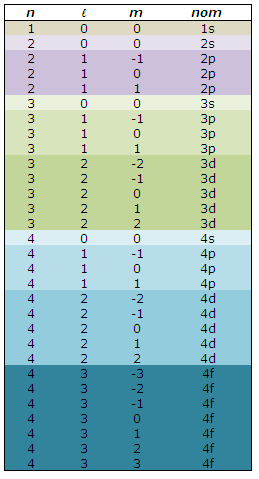
- Si n = 2 et m = -1, quelles sont toutes les valeurs possibles de l ?
l=1 (une des orbitales 2p)
- Si n = 2 et m = 0, quelles sont toutes les valeurs possibles de l ?
l=0 et l=1
( l'orbitale 2s pour 0 et une des orbitales 2p pour 1)
- Si l = 2 et n = 3, quelles sont toutes les valeurs possibles de m ?
m=-2; m=-1; m=0; m=1 et m=2 (les 5 orbitales 3d)
- Si l = 0 et n = 5, quelles sont toutes les valeurs possibles de m ?
m=0
- Si m = 1 et l = 1, quelles sont toutes les valeurs possibles de n ?
n=2 ou 3 ou 4 ou 5 etc... (une des orbitales 2p, une des 3p, des 4p, etc...)

