
Atomes polyélectroniques — Exercices et problèmes
4.1
Un électron a pour nombre quantique principal
n = 4 et pour nombre quantique tertiaire
m = 2. Les affirmations suivantes sont-elles exactes? Sinon pourquoi?
- cet électron a nécessairement pour nombre quantique l = 2
- cet électron peut avoir pour nombre quantique l = 2
- cet électron est nécessairement dans une orbitale d
a) non; b) oui; c) non
4.2
Classez les orbitales suivantes dans l'ordre dans lequel on les utiliserait si on construisait les éléments dans leur état fondamental un à un, par ordre de Z, en ajoutant successivement un proton au noyau et un électron à l'atome:
- n = 3; l = 1; m = 0; s = +½
- n = 4; l = 0; m = 0; s = -½
- n = 3; l = 2; m = 1; s = -½
- n = 3; l = 0; m = 0; s = +½
- n = 3; l = 1; m = -1; s = +½
d < a = e < b < c
4.3
Parmi les configurations électroniques suivantes, lesquelles sont impossibles et pourquoi?
- 1s2 2s1 2p1
- [Ne] 3s2 3p2 3d2
- 1s2 2s2 2p6 3s3
- [Ar] 3d10 4s1 4p3
- 1s2 2s2 2p6 2d2
c et e impossibles
4.4
La couche de valence d'un atome est constituée des électrons dont les régions de forte probabilité de présence sont les plus éloignées du noyau. Ce sont ces électrons qui participent aux liaisons chimiques. A l'aide du
tableau périodique, décrire la couche de valence des atomes suivants: nombre d'électrons appariés (2 électrons dans la même orbitale), nombre d'électrons célibataires (1 seul électron dans l'orbitale) et nombre d'orbitales vides:
(a) B (Z = 5)
(b) S (Z = 16)
(c) As (Z = 33)
(d) Rb (Z = 37)
(e) Xe (Z = 54)
a) 1 paire, 1 célibatoire, 2 vides; b) 2 paires, 2 célibataires et aucune vide; c) 1 paire, 3 célibataires, 0 vide;
d) 0 paire, 1 célibataire, 3 vides; e) 4 paires, 0 célibataire, 0 vide.
4.5
Quels seraient le numéro atomique et la configuration électronique de l'élément encore inconnu qui, dans le
tableau périodique, se placerait sous le radon Rn (Z = 86)?
Z = 118; [Rn] 7s2 5f14 6d10 7p6 (écriture en ordre de remplissage) ou [Rn] 5f14 6d10 7s2 7p6 (écriture en ordre de n)
4.6
Combien d'orbitales portent le nom (a) 5p (b) 3d (c) 4d
(a) 3; (b) 5; (c) 5
4.7
Pour représenter graphiquement la région de l'espace où la probabilité de présence de l'électron est la plus grande, on utilise souvent une surface sur laquelle la densité de probabilité est constante et qui englobe un volume de l'espace dans lequel la probabilité de présence de l'électron est 90%. Pourquoi n'utilise-t-on pas plutôt une surface englobant une probabilité de présence de 100% ?
Indice
4.8
Qu'est-ce qui distingue les 3 orbitales 2p entre elles ?
4.9
Quel est le nombre maximum d'électrons décrits par les nombres quantiques suivants:
a) n = 4 b) n = 3 et l = 2 c) n = 2 et l = 1 d) n = 0, l = 0 et m = 0 e)n = 2, l = 1 et m = -1 f) n = 1, l = 0 et m = 0 g) n = 1, l = 0 et m = 1
a) 32; b) 10; c) 6; d) 0; e) 2; f) 2; g) 0
4.10
Un atome d'oxygène possède la configuration électronique 1s
2 2s
2 2p
x2 2p
y2. Cet atome est-il dans son état fondamental? Pourquoi?
Indice
4.11
Identifiez les trois éléments (différents) suivants:
- un état excité de cet élément possède la configuration électronique 1s2 2s2 2p5 3s1
- un état excité de cet élément possède la configuration électronique [Kr] 5s2 4d6 5p2 6s1
- cet élément possède à l'état fondamental 3 électrons célibataires dans des orbitales 6p.
a) Ne; b) Ag; c) Bi
4.12
Tracez schématiquement la densité de probabilité radiale des orbitales 2p et 3s d'un même atome polyélectronique. Que peut-on déduire de ces courbes en ce qui concerne la probabilité de présence des électrons de ces orbitales, en fonction de la distance au noyau?
Solution détaillée
4.13
Sous l'action d'une source d'énergie extérieure, tous les électrons d'une collection d'atomes d'hélium sont excités dans des orbitales 3s.
- Combien de raies observera-t-on dans le spectre électromagnétique émis par les atomes lors de leur retour à l'état fondamental? Représentez sur un diagramme d'énergie schématique toutes les transitions observées.
- Combien de raies observerait-t-on si on répétait la même expérience avec des atomes d'hydrogène?
Notes: on ne demande pas les longueurs d'onde. On suppose que toutes les transitions sont permises.
(a) 6 (b) 3 - Solution détaillée
4.14
Estimez, à l'aide de la
figure donnant l'énergie des orbitales des atomes neutres en fonction de Z:
- la longueur d'onde de la radiation électromagnétique capable d'exciter un électron d'un atome de zinc (Zn) d'une orbitale 4s à une orbitale 4p;
- l'énergie d'ionisation du sodium Na. Exprimez le résultat en électron-volts, en joules et en kilojoules par mole.
(a) 138 nm (b) 5.56 eV - Solution détaillée
4.15
Déterminez la longueur d'onde de la radiation électromagnétique permettant d'exciter un électron 2s de l'atome d'oxygène dans une orbitale 2p.
82.098 nm - Solution détaillée
4.16
Lorsqu'une radiation électromagnétique de grande énergie frappe une surface, on observe l'éjection d'un électron du coeur de l'atome, par exemple des orbitales 1s ou 2s. C'est le phénomène utilisé dans la technique de spectroscopie photo-électronique des rayons-X (
XPS, appelée aussi
ESCA), qui permet l'identification des atomes présents à la surface d'un échantillon. Quelle est l'énergie minimum nécessaire pour arracher un électron 1s du carbone?
288.23 eV - Solution détaillée
4.17
On s'interesse à l'énergie de première ionisation des éléments d'une même période.
- Expliquez pourquoi, par exemple du sodium Na à l'argon Ar, l'énergie de première ionisation I1 tend à augmenter.
- Malgré cette tendance, on remarque expérimentalement que I1 diminue du phosphore (I1=1060 kJ.mol-1) au soufre (I1=1005 kJ.mol-1). Expliquez pourquoi.
Solution détaillée
4.18
Uniquement à l'aide de leur position dans le
tableau périodique, indiquez pour chacune des paires d'atomes suivantes, celui qui possède la plus grande énergie de première ionisation et la plus grande taille:
- Li et K
- B et N
- F et C
4.19
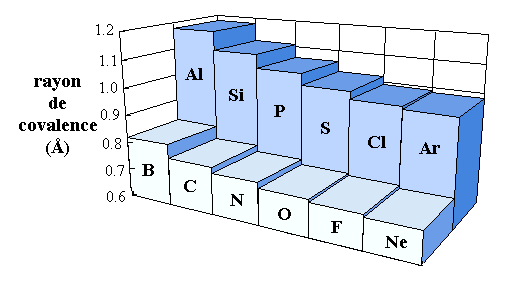
La figure ci-contre montre le rayon de covalence (une mesure de la taille de l'atome) de quelques éléments. Expliquez en quelques phrases les tendances observées.
Solution détaillée

 La figure ci-contre montre le rayon de covalence (une mesure de la taille de l'atome) de quelques éléments. Expliquez en quelques phrases les tendances observées.
Solution détaillée
La figure ci-contre montre le rayon de covalence (une mesure de la taille de l'atome) de quelques éléments. Expliquez en quelques phrases les tendances observées.
Solution détaillée