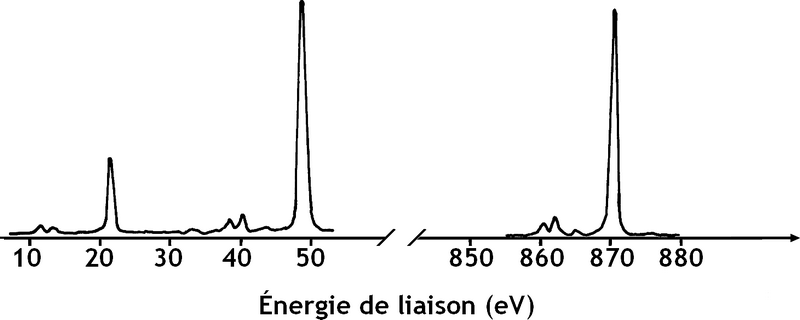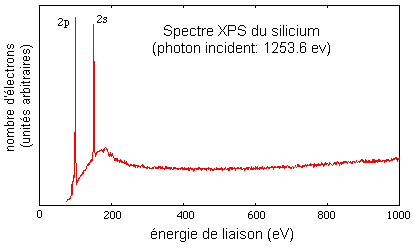
La même technique sert aussi à l'analyse chimique (Electron Spectroscopy for Chemical Analysis ou ESCA), par exemple la détection des éléments présents dans les sédiments marins.
La technique XPS est une des méthodes qui permet de déterminer expérimentalement l'énergie des orbitales atomiques des éléments.