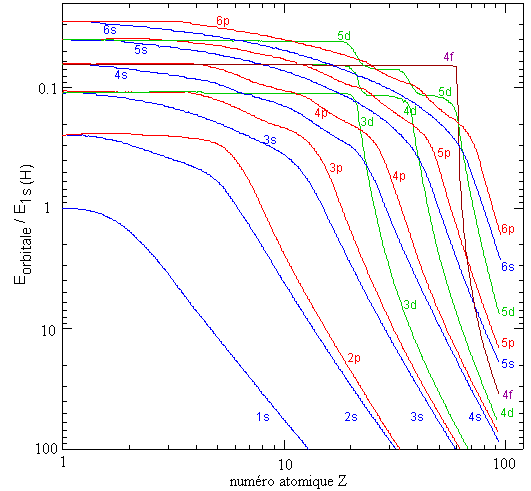
Expliquez pourquoi, pour n'importe quel atome neutre:
- l'énergie de l'orbitale 2p est supérieure à celle de l'orbitale 2s;
- l'énergie de l'orbitale 3d est supérieure à celle de l'orbitale 3p, elle-même supérieure à celle de l'orbitale 3s;
Pourquoi cet effet n'existe-t-il pas pour l'hydrogène?
 Exercices interactifs sur l'utilisation de ces figures
Exercices interactifs sur l'utilisation de ces figures