
Le benzène
La molécule de benzène possede une structure plane, dans laquelle tous les angles de liaison C—C ou C—H sont de 120°. On en déduit que les liaisons impliquent des orbitales hybrides sp2 du carbone. Pour former une molécule, on part de 30 orbitales atomiques de valence (6 1s des hydrogènes, 6 2s des carbones et 3×6 2p des carbones) et on construira donc 30 orbitales moléculaires:
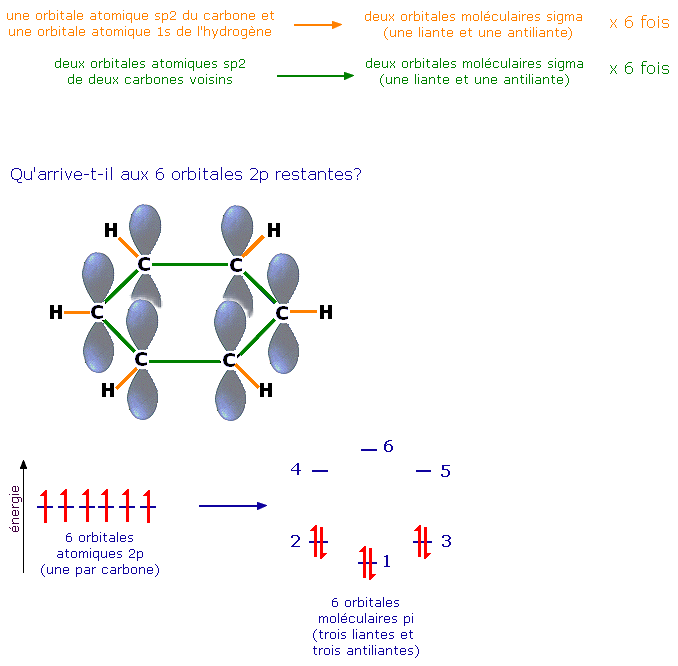
Les 30 électrons de valence sont dans 15 orbitales moléculaires liantes: 24 électrons sont engagés dans 12 liaisons localisées entre deux atomes voisins de la molécule (soient deux carbones, soient un carbone et un hydrogène). Six électrons occupent des orbitales moléculaires π délocalisées construites à partir de 6 orbitales 2p, une par atome de carbone.
Représentation interactive 3D des orbitales moléculaires du benzène (requiert Java)

