Hybridation
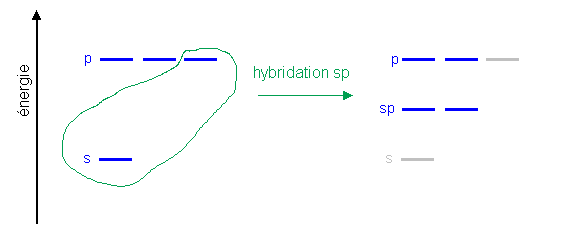
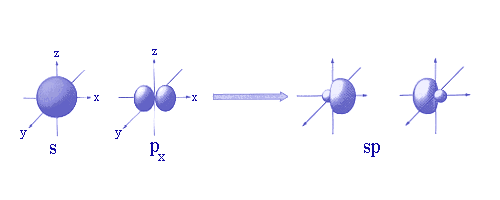
Les orbitales moléculaires font parfois intervenir des orbitales atomiques hybrides, telles que les orbitales atomiques hybrides sp:
Les deux hybrides sp sont orientés sur le même axe, avec des directions opposées (angle=180°).
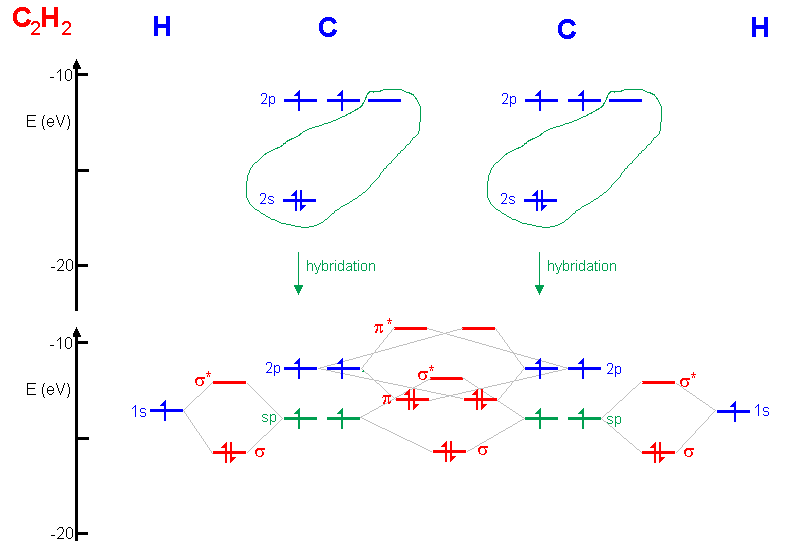
Par exemple, c'est une orbitale sp qui donne, par combinaison linéaire avec une orbitale atomique 1s, une orbitale moléculaire σ dans la liaison C-H de l'acétylène (C2H2):
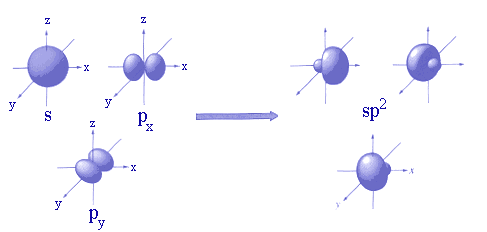
Une orbitale atomique hybride sp2:
intervient par exemple dans la formation d'une orbitale moléculaire σ dans la liaison C-H de l'éthylène C2H4, par combinaison linéaire avec une orbitale atomique 1s.
Les trois hybrides sp2 sont dans le même plan, dans des directions orientées à 120° l'une de l'autre.
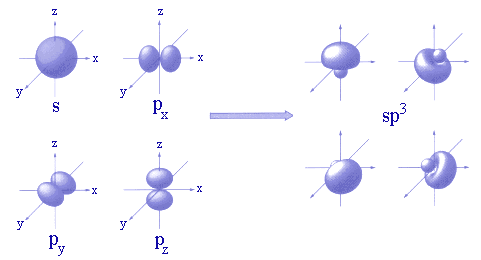
Une orbitale moléculaire σ peut résulter de la combinaison linéaire d'une orbitale atomique 1s et d'une orbitale atomique hybride sp3
par exemple dans la liaison C-H de l'éthane C
2H
6 ou du méthane CH
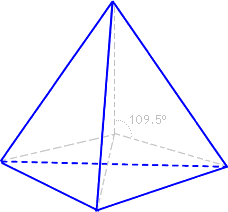
4. Les quatre hybrides
sp3 sont orientés selon une géométrie tétraédrique, l'axe de chaque orbitale faisant un angle de 109.5° avec les autres:
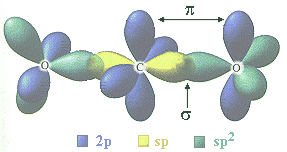
Dans les liaisons C-O du dioxyde de carbone, une orbitale moléculaire σ résulte de la combinaison linéaire d'une orbitale atomique hybride sp du carbone et d'une orbitale atomique hybride sp2 de l'oxygène:
Représentation interactive 3D des orbitales hybrides (requiert Java)