
Combinaison linéaire des orbitales atomiques (LCAO): énergie des orbitales moléculaires
La combinaison linéaire de deux orbitales atomiques (OA) donne deux orbitales moléculaires (OM): une est liante et d'énergie inférieure à l'énergie des orbitales atomiques (OA) d'origine; l'autre est antiliante (symbole accompagné d'un astérisque), et d'énergie supérieure à celle des OA parentes. La différence d'énergie entre OA et OM liante est égale à la différence entre OM antiliante et OA:
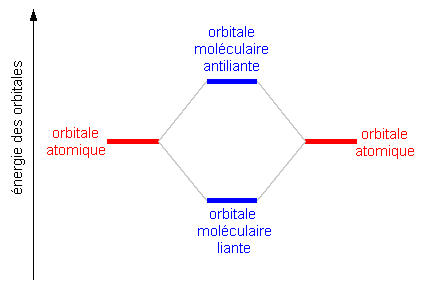
Cette différence d'énergie dépend de la distance entre les noyaux, la différence augmentant lorsque les noyaux se rapprochent. Lorsque les noyaux sont proches cependant, le travail qu'il faut fournir pour vaincre les répulsions électrostatiques contribuent à augmenter l'énergie:
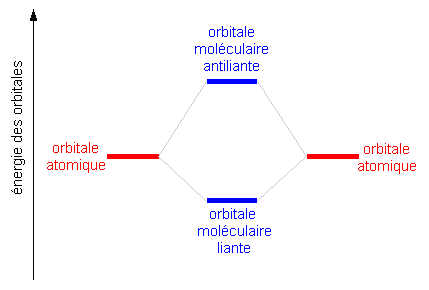
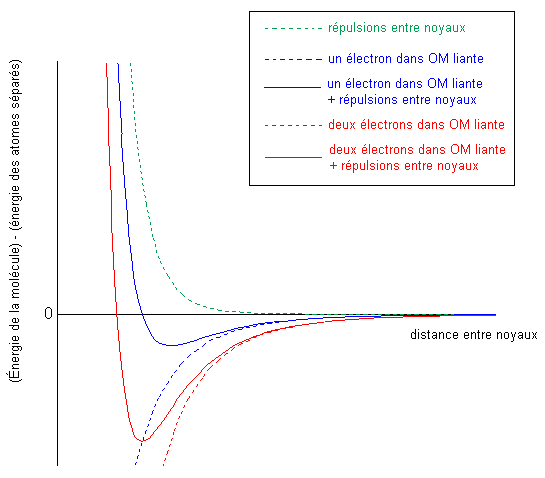
Cette contribution de la répulsion entre noyaux est aussi à l'origine d'un minimum d'énergie pour la liaison à une distance donnée, selon le nombre d'électrons dans les OM liantes et antiliantes:
Illustrations
i.1
Montrez que le modèle ondulatoire permet bien de retrouver que la molécule He2 n'existe pas, car elle est instable.
i.2
À partir de la figure ci-dessus, à compléter au besoin, prédire la position du minimum d'énergie dans une liaison à trois électrons, deux dans l'OM liante et un dans l'antiliante.



