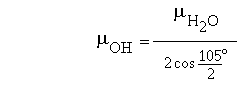Énoncé
Pour une molécule contenant plusieurs liaisons polaires, le moment dipolaire de la molécule est la résultante des vecteurs moments dipolaires de chacune des liaisons. Les deux liaisons H-O de la molécule d'eau font un angle égal à 104.45°. Sachant que le moment dipolaire expérimental de l'eau est égal à 1.8546 D, calculer le moment dipolaire que l'on peut associer à la liaison H-O.
Réponse
On peut représenter une molécule d'eau de la façon suivante:
L'atome d'oxygène étant plus électronégatif (électronégativité: 3.44 sur l'échelle de Pauling) que l'hydrogène (électronégativité: 2.10), chaque liaison O-H est polaire:
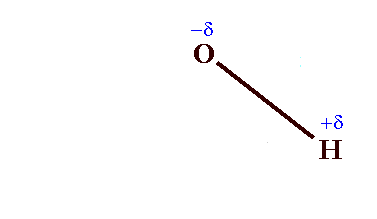
On peut lui associer un moment dipolaire de liaison, µOH:

qui est un vecteur dirigé sur l'axe des deux charges, de -δ à +δ, et de module:
µOH = δ × (distance entre O et H)
Le moment dipolaire de la molécule d'eau est le vecteur résultant des deux vecteurs µOH orientés avec un angle de 104.45°:
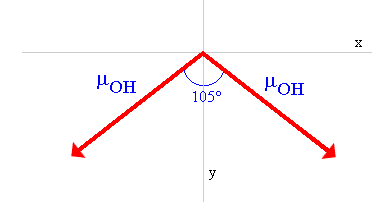
La résultante est sur la bissectrice (notée axe y sur la figure ci-dessus) de l'angle entre les deux moments dipolaires de liaison. Pour en déterminer le module, on décompose chaque vecteur µOH en ces deux composantes sur les axes x et y:
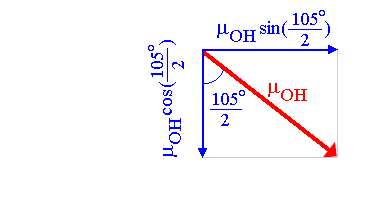
ce qui donne pour la molécule:
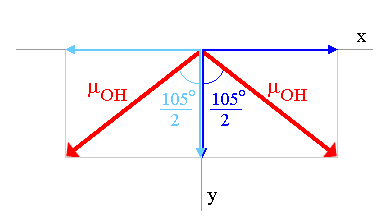
Les composantes sur l'axe x, qui sont de même module µOHsin(104.45°/2) mais de sens opposés, s'annulent.
Le moment dipolaire de la molécule est donc la résultante des deux composantes sur l'axe y:
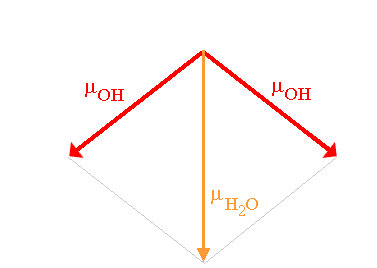
Son module est:
µmolécule d'eau = 2µOHcos(104.45°/2)
Cette expression permet le calcul de µOH:
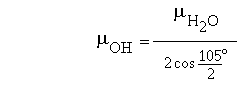
qui conduit à µOH = 1.8546 / ( 2 × cos(½×104.45°) ) = 1.514 D