![]()

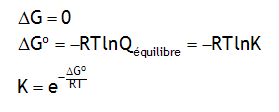
H2 (g) + ½ O2 (g) → H2O (g)
La réaction est-elle spontanée? Comment changent ΔG° et la constante d'équilibre si on écrit plutôt la réaction:2 H2 (g) + O2 (g) → 2 H2O (g)
1.106×1040; réaction explosive!; K'=K2 et ΔG°'=2ΔG°N2 (g) + 3 H2 (g) → 2 NH3 (g)
La réaction est-elle spontanée? Calculez ΔG et le quotient de la réaction dans un réacteur où les pressions d'ammoniac, d'azote et d'hydrogène sont maintenues à 1bar, 25 Pa et 25 Pa respectivement. La réaction est-elle spontanée dans ces conditions? -32.90 kJ.mol-1; 5.805×105; réaction spontanée; Q = 2.560×1014; ΔG = 49.34 kJ.mol-1; réaction non spontanée.