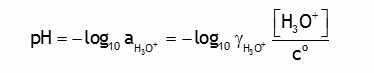Quel est le pH de l'eau pure à 25°C? à 37°C? On négligera dans un premier calcul les effets de force ionique; on discutera ensuite la nécessité d'en tenir compte dans ce cas.
7.00 à 25°C; 6.80 à 37°C
Une solution aqueuse de force ionique I=0.01 contient des ions HCO
3¯ et des ions CO
32¯. La concentration molaire des ions H
3O
+ dans la solution est 10
-10 M. Les concentrations de H
2CO
3 (aq) et CO
2 (aq) sont négligeables.
- Calculez le rapport des molarités
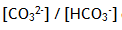 dans la solution;
dans la solution;
- Calculez le pH de la solution;
- Que deviennent les réponses si on considère que la solution est idéale ? Que peut-on en conclure sur la nécessité de tenir compte en pratique des coefficients d'activité?
a) 0.6956; b) 10.04; c) 0.4677 et 10.00.
![]()