
Solubilité des gaz dans l'eau — Exercices et problèmes
5.1
Quelle quantité de CO2 est dissoute dans 1 litre de boisson gazeuse à 25°C si l'embouteilleur utilise une pression de 2.4 atm CO2 pour gazéifier la boisson? Quel volume de gaz cela représente-t-il si on l'extrait entièrement du liquide? (NB: on supposera qu'aucune réaction acide-base ne se produit entre l'eau et CO2 dissous)
2 litres
5.2
5.3
À l'aide des tableaux de données thermodynamiques dans le
recueil de données, calculez (a) K, la constante de Henry thermodynamique et (b) K
H,b/P pour O
2.
(a) 0.001383; (b) 0.001344 mol.kg-1.bar-1
5.4
Calculez la molalité et la concentration massique de l'oxygène dissous dans une eau en équilibre avec l'atmosphère. On pourra utiliser la constante de Henry fournie par le
NIST Chemistry WebBook. La pression partielle de l'oxygène dans l'air est .2 bar.
bO2=2.6×10-4 m, soit 8.3 ppm
5.5
5.6
On utilise parfois une autre forme sans dimension de la constante de Henry, KH,x/x, où x/x représente x(g)/x(aq). Montrez que KH,P/x = KH,x/xP
5.7
La limite d'exposition aux vapeurs de tétrachlorure de carbone CCl4 (M=153.823 g.mol-1) en milieu de travail est 30.0 mg/m3 d'air. On traite des eaux d'égouts dans des réservoirs étanches dans lesquels des travailleurs doivent pénétrer. Quelle est la quantité maximum de CCl4 dissous (exprimée en mg/m3 d'effluent) que des rejets liquides peuvent contenir à 25°C?
31.5 mg/m3 d'eau
5.8
On cherche à dépolluer une eau dans une tour d'aération (par lavage à l'air ou
air stripping) à 25°C.
- Montrez que
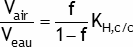
où Vair est le volume d'air, Veau le volume d'eau polluée, KH,c/c est la constante de Henry du polluant dans l'eau et f est la fraction du polluant qui se trouve dans l'air.
- Avec quel volume d'air doit-on laver une eau polluée pour en éliminer 99% du trichloroéthylène dissous?
- Que devient la réponse si on veut plutôt éliminer 99.9% du polluant?
- Que deviennent ces réponses si le polluant est du benzène?
a) Vair/Veau=244 soient 244 litres d'air par litre d'eau;
b) Vair/Veau=2459;
c) 559 et 5636
5.9
La solubilité des gaz dans l'eau provoque un certain lessivage des polluants atmosphériques par l'eau de pluie. Quelle quantité d'eau (en mm de pluie) doit tomber d'un nuage situé à 2 km d'altitude pour réduire de moitié la quantité de vapeur de phénol C
6H
5OH (g) dans l'atmosphère? (On prendra
KH,P/x = 0.0095 atm et on négligera la dissociation acide du phénol)
14 mm
5.10
À l'aide des tableaux de données thermodynamiques dans le
recueil de données, calculez la solubilité (en mg/litre) du méthane (a) à 25°C et (b) à 90°C dans une solution aqueuse en équilibre avec une pression de 5 atm de méthane gazeux.
(a) 112 mg/litre; (b) 40 mg/litre
5.11
On a construit les diagrammes pC-pH pour l'équilibre entre une solution aqueuse et un volume d'air contenant de l'ammoniac NH
3 (g). Déterminez le pH d'une eau initialement pure en équilibre avec de l'air contenant NH
3 (g), si
- la solution est en équilibre avec un volume infiniment grand d'air contenant 5×10-9 atm d'ammoniac (diagramme);
- l'air contient initialement 10-2 atm d'ammoniac et les volumes d'eau et d'air sont égaux (diagramme);
- l'air contient initialement 10-8 atm d'ammoniac et les volumes d'eau et d'air sont égaux (diagramme);
On a construit un diagramme pC-pH pour le même système, préparé cette fois à partir d'air initialement pur et d'une solution contenant cT moles par litre de nitrate d'ammonium. À l'aide du diagramme:
- déterminez la valeur de cT;
- déterminez le pH de la solution aqueuse.
(a) 8.2; (b) 9.9; (c) 7.0 et non 4.6; (d) 0.1 M; (e) 5.15.

![]()
![]()