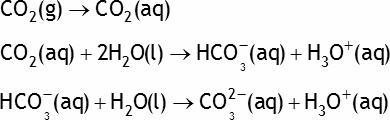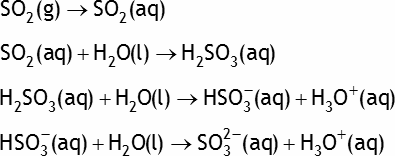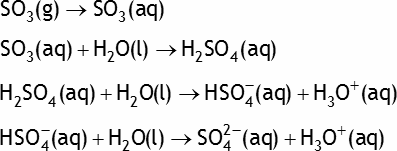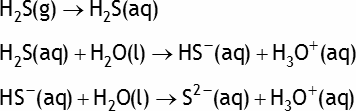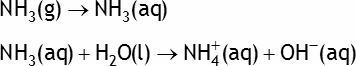Gaz qui réagissent dans l'eau
Exemple: le dioxyde de carbone CO2
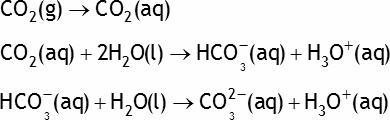
Exemple: le dioxyde de soufre SO2
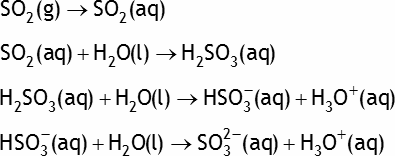
Exemple: le trioxyde de soufre SO3
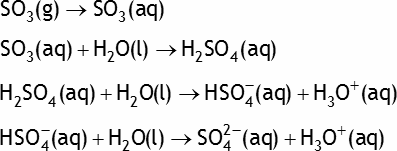
Exemple: le sulfure d'hydrogène H2S
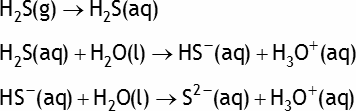
Exemple: l'ammoniac NH3
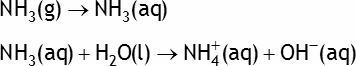
Illustration
i.1
Calculez le pH d'une eau initialement pure en équilibre avec l'atmosphère terrestre. L'air non-pollué contient essentiellement O2, N2 et CO2, ce dernier à une pression de 3.5×10-4 atm.
5.6
Diagrammes pC-pH
Pour un diacide H2A, on peut construire un diagramme pC-pH car les constantes d'acidité permettent calculer la concentration de chacune des espèces en solution à partir du pH:
[H3O+(aq] ⇒ [A2-(aq] ⇒ [HA-(aq] ⇒ [H2A (aq)]
La constante de Henry thermodynamique permet d'ajouter la courbe pour la concentration du diacide dans le gaz:
[H2A (aq)] ⇒ [H2A (g)]
Cependant, il faut maintenant utiliser le nombre de moles (et non la concentration) dans l'équation de conservation de la matière:
ntotal = Veau[A2-(aq] + Veau[HA-(aq] + Veau[H2A (aq)] + Vair[H2A (g)]
et le diagramme dépend des volumes d'air et d'eau.
Si le système est ouvert, par exemple dans un équilibre entre l'atmosphère et l'eau d'un lac par exemple, on ne peut pas écrire de conservation de la matière mais on peut considèrer que [H2A (g)] est constant, indépendant du pH, puisqu'on en a un réservoir infini.
Illustration
i.2

![]()