
Solubilité des sels peu solubles

Produit de solubilité
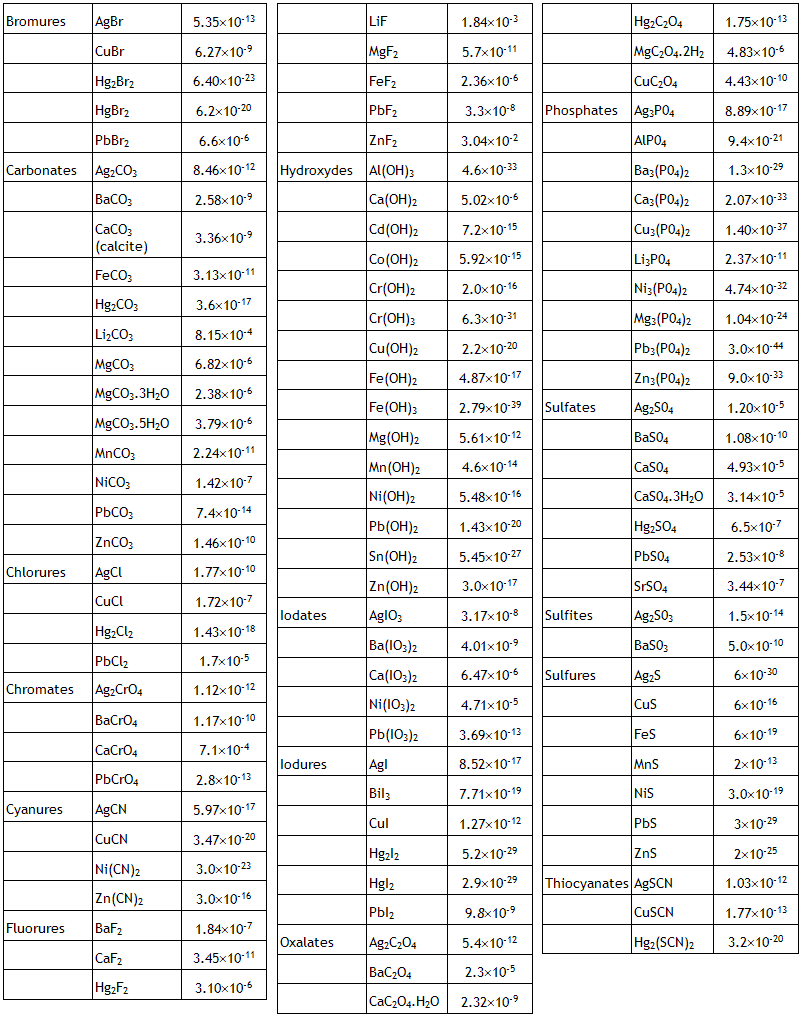
Autres sources
- Principles and Applications of Aquatic Chemistry, Morel & Hering
- CRC Handbook of Chemistry and Physics
Illustrations
i.1
Écrivez Ksp en fonction des concentrations en solution, puis en fonction de la solubilité du sel, s, pour le chlorure d'argent, l'iodate de plomb et le phosphate de magnésium.
i.2
Quelle est la concentration d'iodate (extrapolée à force ionique nulle) dans une solution aqueuse saturée d'iodate de plomb à 25°C?
9.04×10-5 M
i.3
Que se passe-t-il lorsqu'on mélange, à 25°C, 0.050 L d'une solution 2×10
-2M de fluorure de sodium NaF et 0.010 L d'une solution 1×10
-2M de nitrate de calcium Ca(NO
3)
2 ?
CaF2 précipite — solution détaillée
i.4
La solubilité du bromure d'argent à 25°C, extrapolée à force ionique nulle, est 1.367×10
-4g/L.
- Calculez le produit de solubilité et ΔG° à 25°C
- Comparer ΔG° avec la valeur tirée des tableaux de données thermodynamiques;
- Calculez la solubilité de AgBr à 75°C.
a) 5.3×10-13; +70.0 kJ/mol; b) valeur identique +70.0 kJ/mol; d) AgBr est 11.5 fois plus soluble à 75°C.
Effet de la force ionique
i.5
le thiocyanate de mercure (II) Hg(SCN)2 est peu soluble dans l'eau (Ksp=2.8×10-20), donnant des ions Hg2+ et SCN¯. Quelle est la solubilité (a) so à force ionique nulle? (b) s dans une solution aqueuse 0.03 M de chlorure de magnésium, MgCl2, un électrolyte fort complètement soluble (les sels HgCl2 et Mg(SCN)2 sont aussi des électrolytes forts complètement solubles)?
so = 2.000×10-7 M; s = 3.240×10-7 M
Effet d'ion commun
i.6
Calculez la solubilité du chlorure d'argent AgCl à 25°C (a) à force ionique nulle et (b) dans une solution de KCl 0.01 M?
so = 1.330×10-5 M; s = 2.195×10-8 M

![]()

