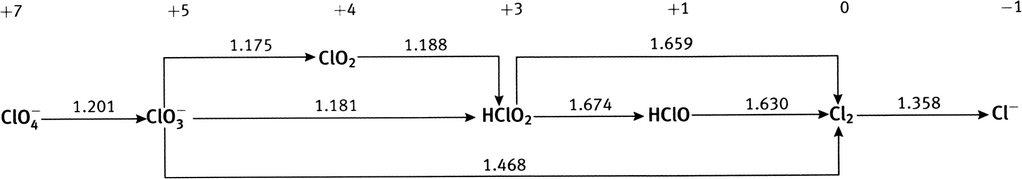
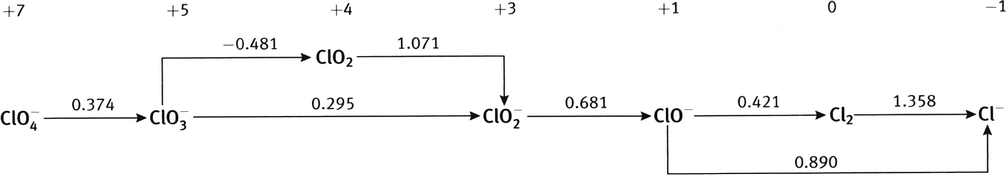
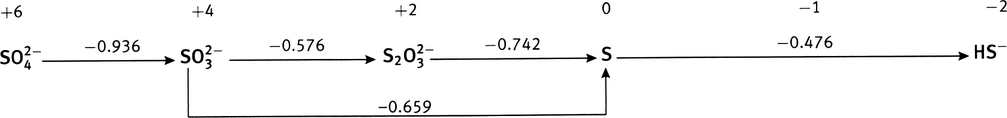
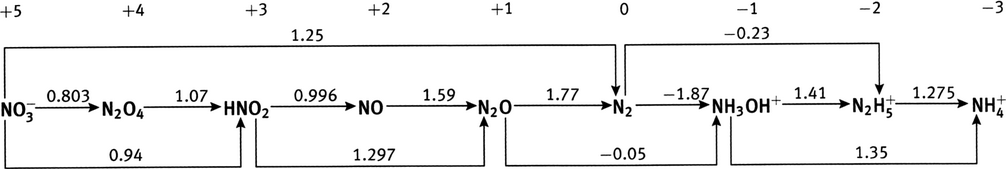
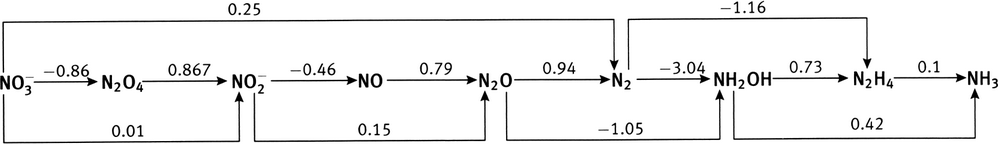
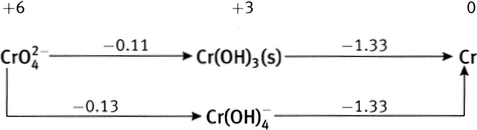
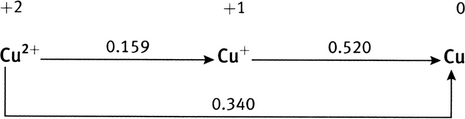
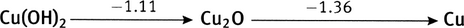À partir des potentiels de réduction standard des couples Fe
3+/Fe et Fe
2+/Fe,calculez le potentiel de réduction standard de Fe
3+ en Fe
2+. Comparez avec la valeur donnée dans les tableaux de E°. Représentez les résultats sur un diagramme de Latimer.
0.783 V, à comparer à la valeur du tableau, 0.771 V (une différence de 1.6%); diagramme de Latimer
![]()