
Introduction
i.1
On s'interesse au couple HCO
3¯(aq)/CH
4(aq).
- Calculez le potentiel de réduction standard.
- Donnez l'équation du potentiel de réduction E en fonction du pH, dans une eau souterraine où [HCO3¯(aq)]=10-3M et [CH4(aq)]=5×10-6M.
- Représentez graphiquement cette équation E(pH); Ajouter schématiquement au diagramme les autres courbes E(pH) appropriées.
On négligera les effets de force ionique.
a) 0.1228 V; b) E = 1.0716 - 0.00666pH; c) graphique
Diagrammes de Pourbaix
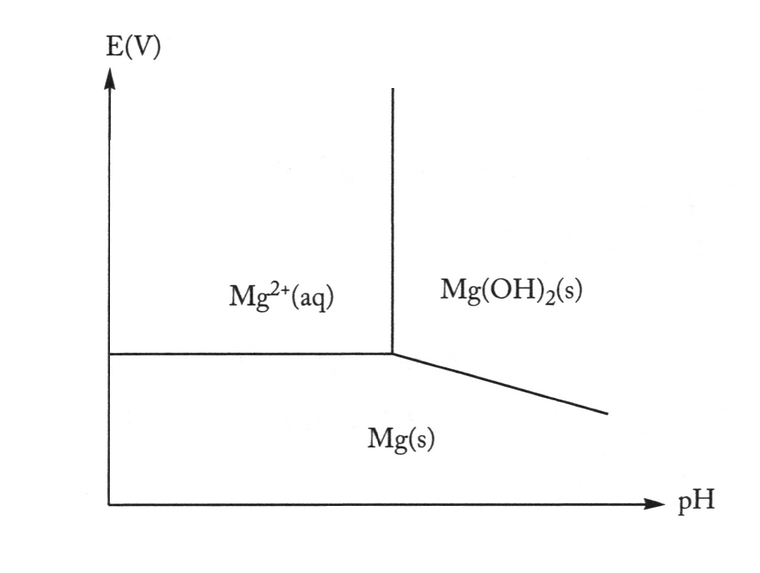
i.2
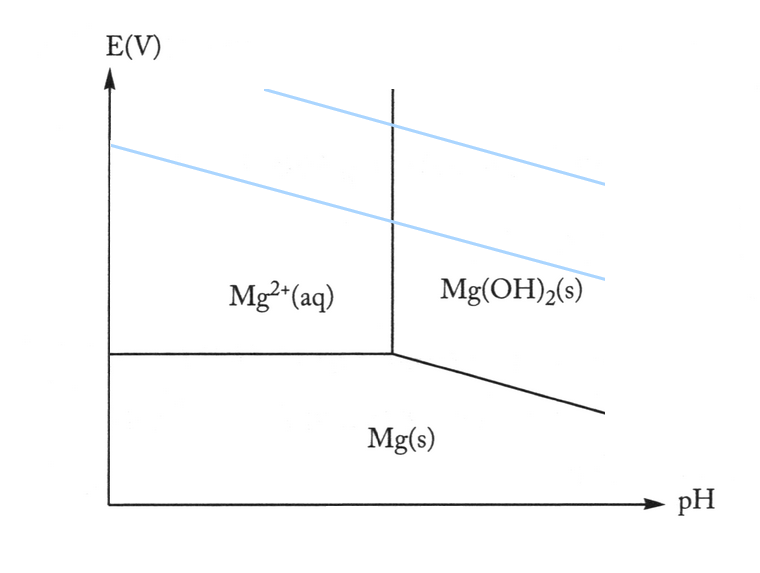
Sans aucun calcul, tracez schématiquement sur la même figure le diagramme de Pourbaix du magnésium et du zinc à la même concentration.
réponse
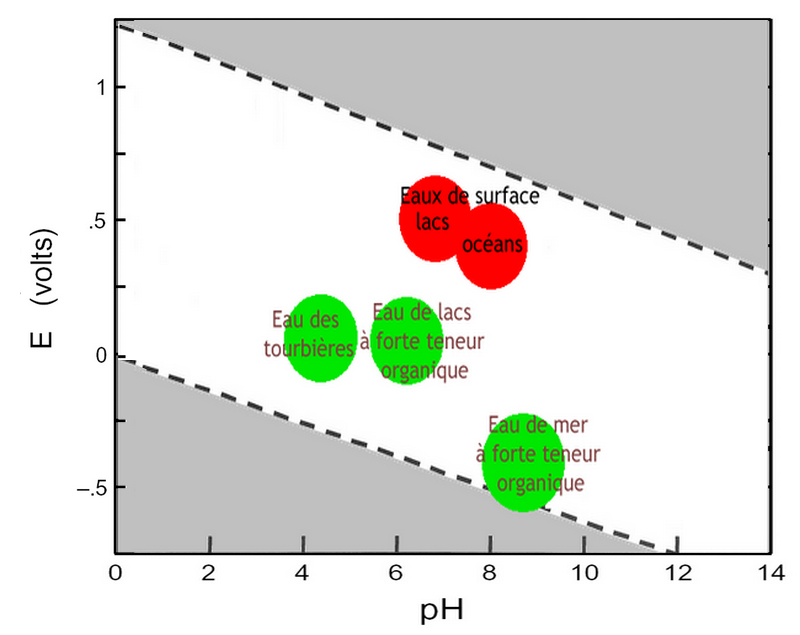
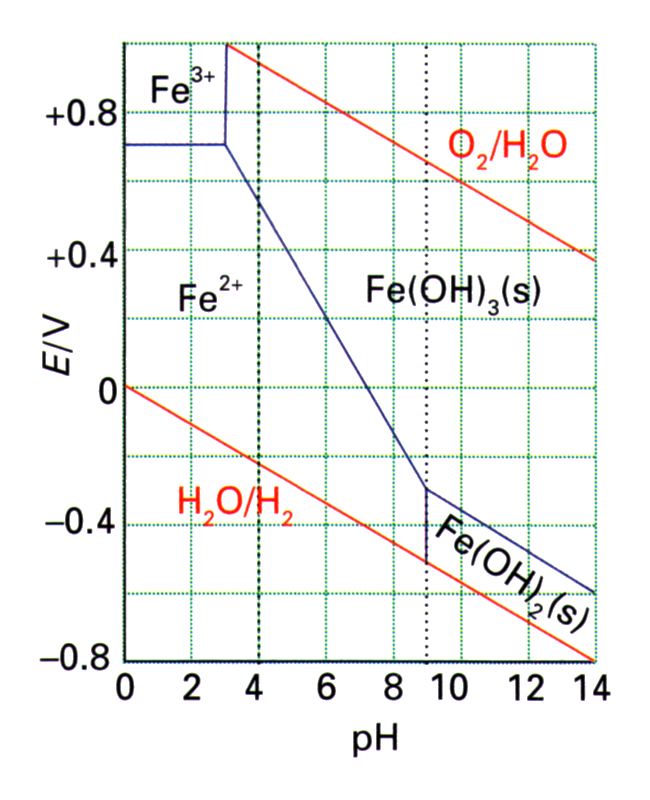
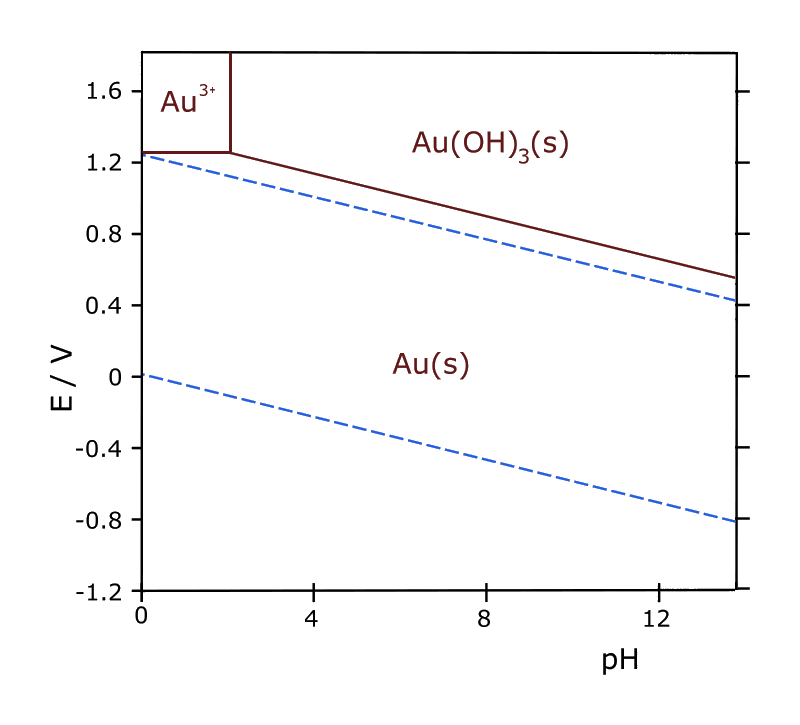
i.3
À l'aide de leur diagramme de Pourbaix, expliquez pourquoi:
- le fer rouille à l'extérieur;
- les objets en fer finissent par disparaître au fond des marécages.
- L'or est (était) un des rares métaux qu'on trouve à l'état natif (métallique) dans la nature.
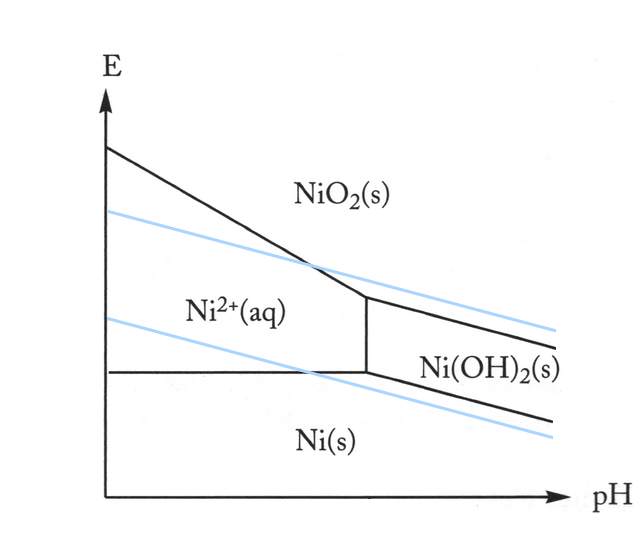
i.4
- Expliquez pourquoi les lignes obliques du diagramme de Pourbaix pour le nickel ont des pentes différentes
- Le nickel est un métal très résistant à la corrosion. Est-ce en accord avec son diagramme de Pourbaix? Proposez une explication.
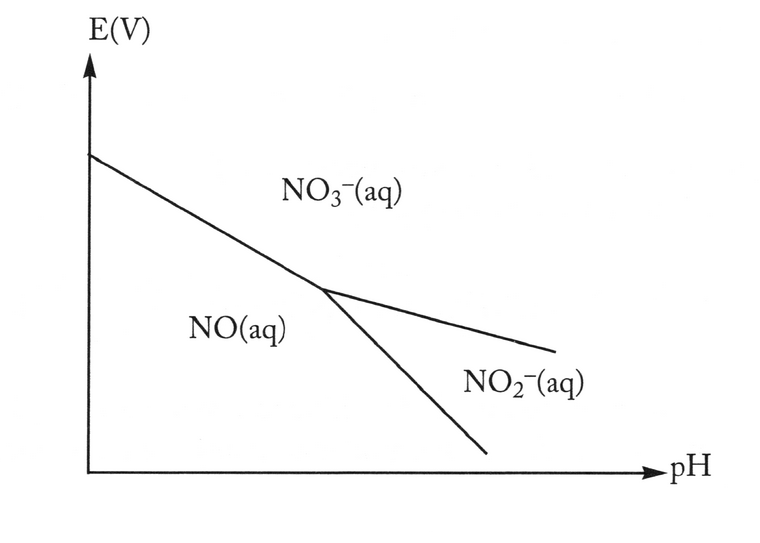
i.5
Pourquoi n'observe-t-on NO2¯ en milieu acide?
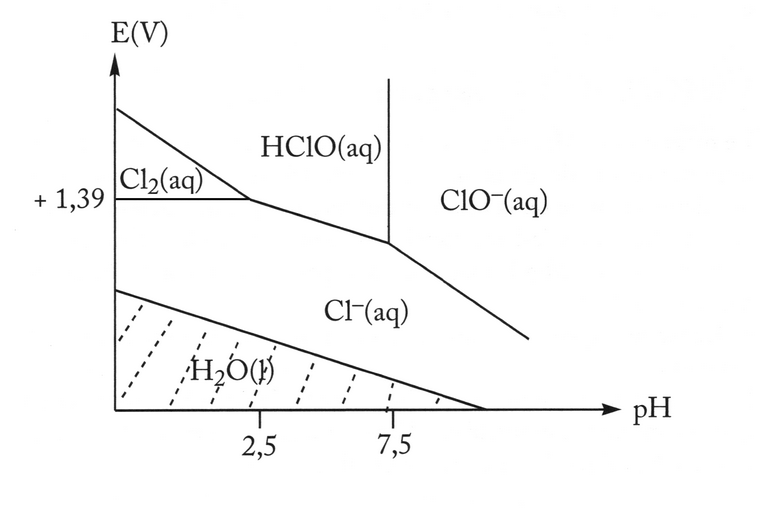
i.6
Quelles espèces du chlore sont capables d'oxyder H2O?
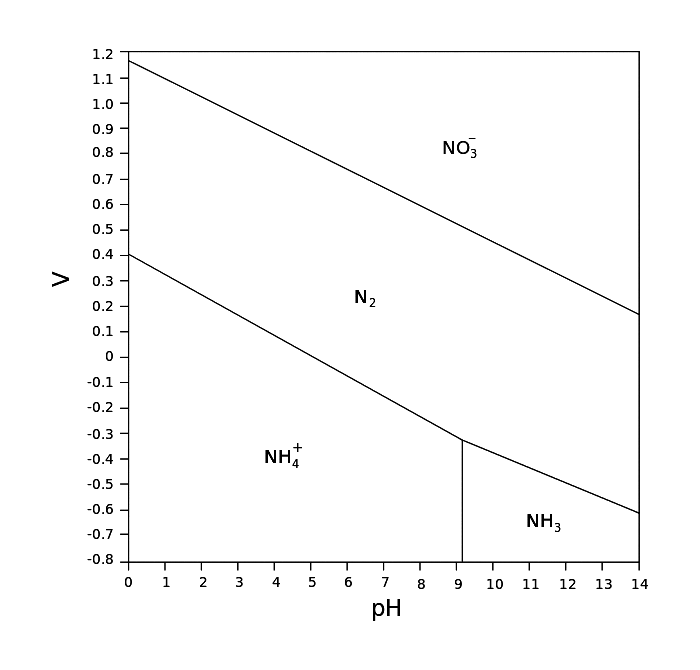
i.7
Que représente la ligne verticale dans le diagramme de Pourbaix précédent?
Source de diagrammes de Pourbaix
- An Atlas of Eh-pH Diagrams, Intercomparison of Thermodynamic Databases, (Geological Survey of Japan, National Institute of Advanced Industrial Science and Technology Research Center for Deep Geological Environments Naoto TAKENO)

![]()








