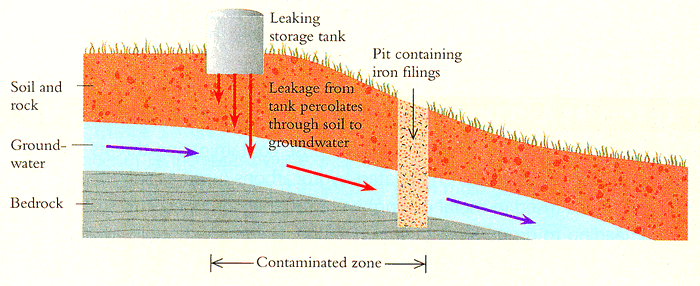
![]()
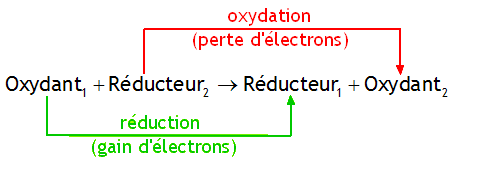
Cu2+ (aq) + Zn (s) → Cu (s) + Zn2+ (aq)
est une oxydoréduction dans laquelle le zinc métallique est oxydé en cation Zn2+ (il perd deux électrons) pendant que le cation Cu2+ est réduit en métal Cu (il gagne deux électrons). La réaction est donc un échange de deux électrons entre deux espèces atomiques.UO22+ (aq) + CH4 (g) → UO2 (s) + HCO3¯ (aq)
CN¯ (aq) + MnO4¯ (aq) → CNO¯ (aq) + MnO2 (s)