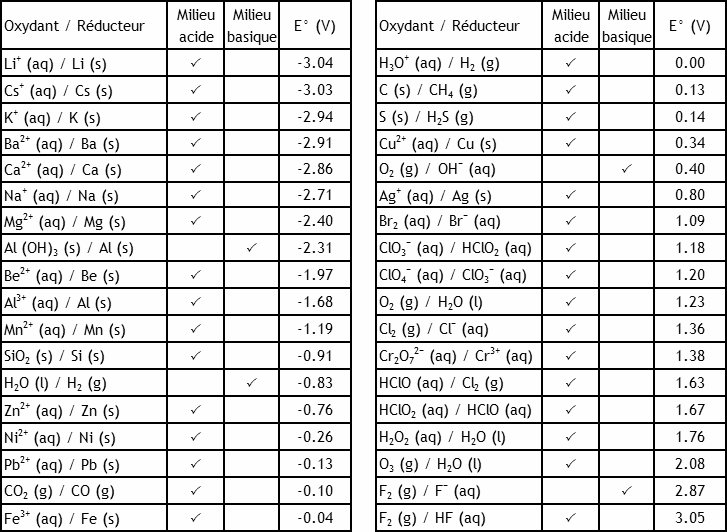
À l'aide des potentiels de réduction standard du
 recueil de données
recueil de données, calculez E° et ΔG° de la réaction dans la pile Daniell. Comparez à la valeur calculée à partir des ΔG° de formation.
1.1037 V; -212.98 kJ/mol, égale à la valeur calculée à partir des ΔG° de formation, -212.55 kJ/mol, à 0.2%.
Si on plonge un morceau de magnésium solide dans une solution aqueuse acide, on observe un dégagement gazeux. Expliquez ce qui se passe.
On fait barboter de l'oxygène O
2 dans une solution aqueuse acide d'ions Fe
2+ et Fe
3+.
- Quelle réaction d’oxydoréduction se produit-il spontanément dans la solution? Écrivez l’équation équilibrée de cette réaction;
- À l'aide des potentiels de réduction standard du
 recueil de données, calculez E°, ΔGº et la constante d’équilibre de l’oxydoréduction à 25ºC;
recueil de données, calculez E°, ΔGº et la constante d’équilibre de l’oxydoréduction à 25ºC;
- Calculez le potentiel de l’oxydoréduction dans une solution de pH=6, placée sous 2000 Pa de O2 (g), et contenant 1000 fois plus de Fe3+ que de Fe2+. La réaction est-elle spontanée dans ces conditions?
Le cas échéant, on négligera les effets de force ionique.
b) 0.458 V; -176.8 kJ.mol-1; 9.273×1030; c) -0.0996 V![]()