Le tétrachlorure de carbone CCl
4 (température de vaporisation standard, c'est-à-dire sous 1 bar: 76.65°C; enthalpie de vaporisation: 29.82 kJ.mol
-1) et le tétrachloroéthylène C
2Cl
4 (température de vaporisation standard: 121.1°C; enthalpie de vaporisation: 39.72 kJ.mol
-1) forment des solutions idéales.
- Quelle est la composition de la solution qui bout à 70°C sous 50.00 kPa?
- Quelle est la composition de la vapeur en équilibre avec cette solution?
- Tracer schématiquement le diagramme de phase liquide-vapeur isotherme à 70°C, en y portant les résultats des calculs précédents et en identifiant toutes les régions du diagramme;
- Tracer schématiquement le diagramme de phase liquide-vapeur isobare sous 50.00 kPa, en y portant les résultats des calculs précédents et en identifiant toutes les régions du diagramme.
a) xCCl4 = 0.5119; b) yCCl4 = 0.8394; c) diagramme isotherme; d) diagramme isobare —
Solution détaillée
Le diagramme ci-dessous a été obtenu pour des solutions idéales A + B sous une pression constante.
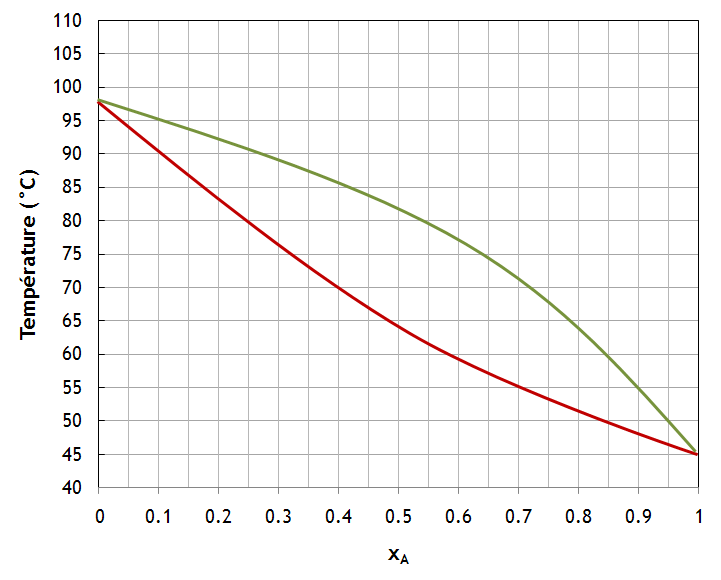
On considère un mélange contenant 1.5 moles de B par mole de A. Sans aucun calcul, à l'aide du graphique:
- Décrire l'évolution du système lorsqu'on chauffe le mélange de 60 à 90°C (nombre et composition des phases à l'équilibre tout au long du processus)
- À quelle température apparaît la première trace de vapeur au chauffage? Quelle est sa composition?
- À quelle température disparaît la dernière trace de liquide au chauffage? Quelle est sa composition?
c) 70ºC; yA = 72%; d) 86ºC; xA = 17%![]()
