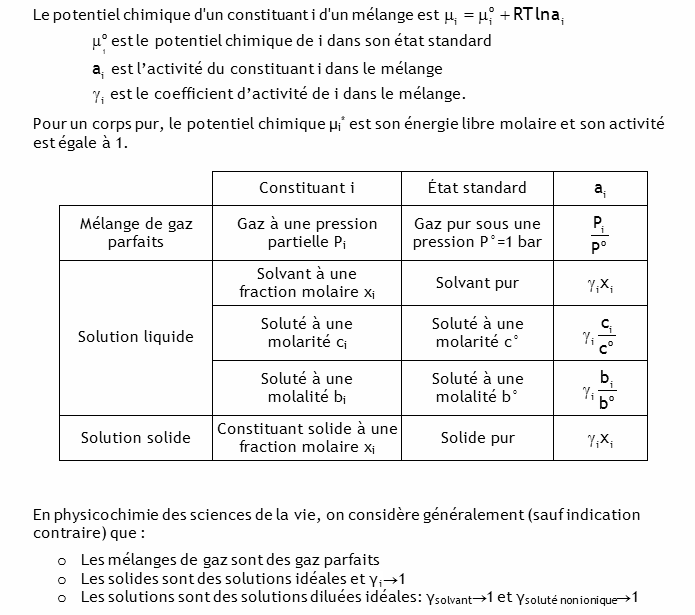
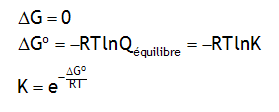La synthèse de la glutamine à 25°C:
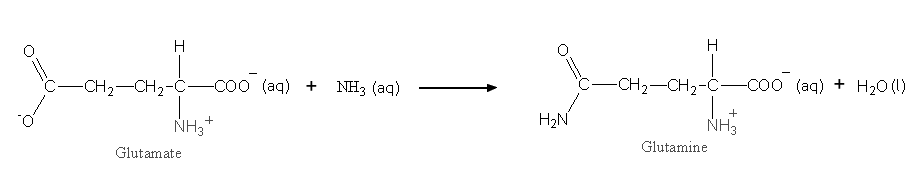
s'accompagne de ΔG°' = +14 kJ. En milieu physiologique la concentration molaire de l'ammoniac dissous est à peu près constante, [NH
3] = 0.01M. Dans quel domaine de [glutamine]/[glutamate] la réaction est-elle spontanée? On supposera que tous les coefficients d'activité tendent vers 1.
[glutamine]/[glutamate] inférieur à 3.53×10-5![]()