
Énoncé
On dissout dans l’eau de l’acétate d’ammonium, un électrolyte fort. On ajuste ensuite le pH de la solution avec HCl ou NaOH. Sans aucun calcul:
- Tracez schématiquement, sur une même figure, la fraction de chacune des espèces en solution provenant de l’acétate d’ammonium initial, en fonction du pH;
- Quelles sont, parmi ces espèces, les deux les plus abondantes à pH=4 ? pH=7 ? pH=10 ?
Solution
L'acétate d'ammonium se dissocie complètement en ions ammonium NH4+ et ion acétate CH3COO¯. NH4+ est un acide faible de pKa=9.25:
NH4+ (aq) + H2O (l) → H3O+ (aq) + NH3 (aq)
CH3COO¯ est la base conjuguée de l'acide acétique, dont le pKa est 4.76. CH3COO¯ est une base faible de pkb = 14-4.76:
CH3COO¯ (aq) + H2O (l) → OH¯ (aq) + CH3COOH (aq)
On retouve donc en solution les quatre espèces NH4+, NH3, CH3COOH et CH3COO¯.
- la fraction de chacune des espèces en solution dépend fortement du pH, avec un changement marqué autour de pKa:
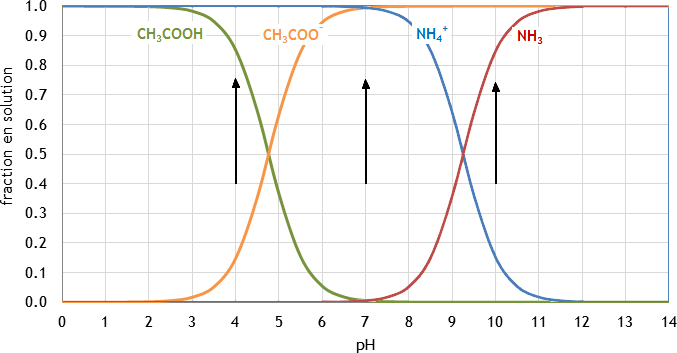
- Le tracé ci-dessus permet de déterminer que les deux espèces les plus abondantes en solution sont:
- à pH=4: NH4+ et CH3COOH
- à pH=7: NH4+ et CH3COO¯
- à pH=10: NH3 et CH3COO¯

![]()
