
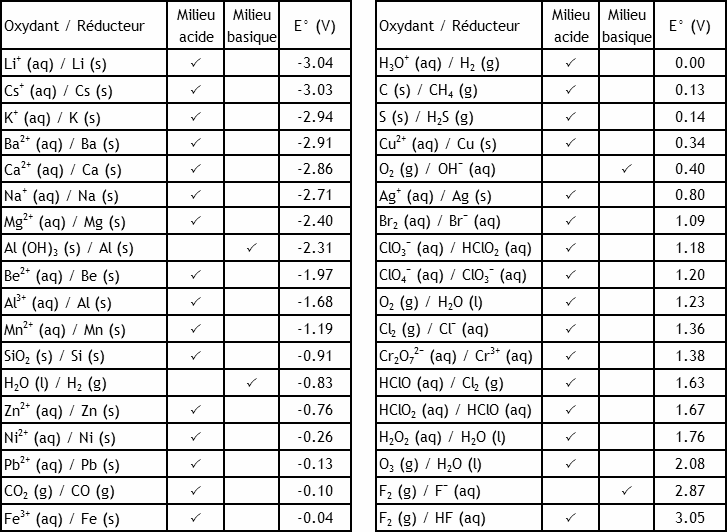
Potentiels de réduction standard
Exemples de potentiels en ordre croissant
Autres sources
Illustrations
i.1
À l'aide des potentiels de réduction standard du
 recueil de données
recueil de données, calculez E° et ΔG° de la réaction dans la pile Daniell. Comparez à la valeur calculée à partir des ΔG° de formation.
1.1037 V; -212.98 kJ/mol, égale à la valeur calculée à partir des ΔG° de formation, -212.55 kJ/mol, à 0.2%.
i.2
Si on plonge un morceau de magnésium solide dans une solution aqueuse acide, on observe un dégagement gazeux. À l'aide des tableaux ci-dessus, expliquez ce qui se passe.
i.3
Une solution aqueuse qui contient de l’acide hypobromeux HBrO, de l’acide hypochloreux HClO et des ions bromates BrO
3¯, est en contact avec Cl
2 (g).
- Quelle réaction d’oxydoréduction se produit-il spontanément dans la solution? Écrivez l’équation équilibrée de cette réaction;
- Calculez E°, ΔGº et la constante d’équilibre de l’oxydoréduction à 25ºC;
- Calculez le potentiel de l’oxydoréduction dans une solution de pH=3.5, placée sous 350 kPa de Cl2 (g) et dans laquelle [HClO (aq)]= 2 µM, [HBrO]= 7 mM et [BrO3¯]= 0.1 M.
On négligera les effets de force ionique.
b) 0.183V; -70.63 kJ.mol-1; 2.362×1012; -0.1356 V
i.4
Calculez le potentiel de réduction standard de Fe3+ en Fe2+ à partir des potentiels de réduction standard des couples Fe3+/Fe et Fe2+/Fe et comparez le résultat avec la donnée du tableau de E°.
0.783 V, à comparer à la valeur du tableau, 0.771 V (une différence de 1.6%).
i.5
Les solutions aqueuses d'eau oxygénée H2O2 (aq) sont instables en présence d'air. Expliquez le phénomène à l'aide des potentiels standard des couples O2/H2O2 et H2O2/H2O. Écrivez l'équation de la réaction d'oxydoréduction (appelée dismutation) qui se produit spontanément. Quel est le potentiel standard de cette réaction?
1.08 V

![]()
