
Solides cristallins - solides amorphes
L'architecture des atomes ou molécules dans les solides présente différents degrés d'ordre:
- Le solide le plus ordonné est le solide cristallin, dans lequel les atomes (ou molécules) suivent une géométrie régulière, périodique. Ils sont placés sur un réseau cristallin, une maille cristalline.
- À l'autre extrême, dans un solide amorphe,les atomes ou molécules ne sont pas arrangés de façon régulière sur de longues distances. C'est le cas par exemple lorsque de trop nombreux défauts brise la régularité, ou encore lorsque les atomes ou molécules sont placées au hasard les unes par rapport aux autres. Un solide complètement amorphe est en quelque sorte un liquide figé.
Connaissez-vous des exemples de solides amorphes?
- De nombreux solides présentent des degrés d'ordre intermédiaire entre un état complétement amorphe et un arrangement parfaitement cristallin. Ce sont les solides semi-cristallins. En connaissez-vous des exemples?
Souvent, une même substance peut se solidifier de différentes façons. Un exemple est la silice, SiO2, qui existe sous deux formes solides: le quartz, cristallin, et le verre, amorphe.
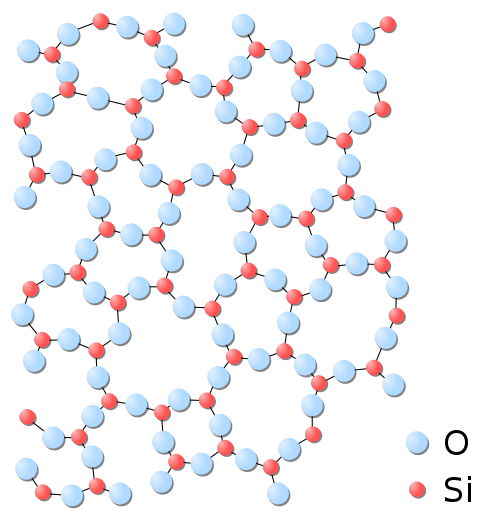
Différences de propriétés entre les solides amorphes et les solides cristallins
Les propriétés physico-chimiques (indice de réfraction, densité, capacité calorifique, etc...) sont différentes pour les solides cristallins et amorphes d'une même substance. Tous les solides cristallins donnent naissance à la diffraction des rayons-X et des électrons, contrairement aux solides amorphes. Par ailleurs les propriétés des solides ordonnés sont anisotropes, c'est-à-dire dépendantes de la direction choisie dans le solide. Par exemple, on peut facilement déchirer une feuille de papier (un empilement de fibres dans le plan de la feuille) mais il est presque impossible de l'allonger. Au contraire, les propriétés des solides amorphes sont isotropes.

![]()
