
Solides covalents
Certains solides contiennent des atomes tous attachés les uns aux autres par des liaisons covalentes. Le solide est un édifice moléculaire tridimensionnel, en quelque sorte une seule molécule. Les solides covalents possèdent des températures de fusion très élevées, puisqu'on ne peut briser le solide qu'en coupant les liaisons.
Exemples
Pour une représentation interactive, cliquez sur l'image.
SiO2 (quartz) (point de fusion > 1600°C)
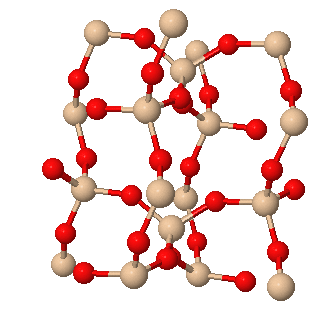
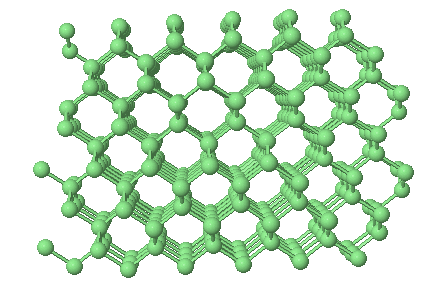
C (diamant) (point de fusion 4093°C)
Propriétés des solides covalents
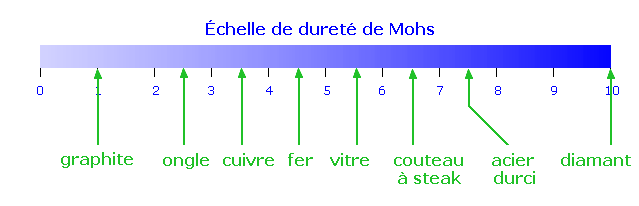
Le diamant est le solide covalent parfait. Il possède une des plus hautes températures de fusion. Il est aussi, comme les autres solides covalents, extrèmement dur. En fait, le diamant est parmi les plus durs: il définit le sommet de l'échelle de dureté (échelle de Mohs):
Les solides covalents sont extrèmement rigides mais peu déformables et par conséquent ne sont pas ductiles.
Le diamant est un isolant électrique, c'est-à-dire qu'il ne transporte pas (il ne conduit pas) le courant électrique. En effet, comme les autres solides covalents, tous les électrons de valence sont localisés dans des liaisons covalentes et ne peuvent donc pas se déplacer librement dans le matériau.
Chimiquement, les solides covalents sont très inertes (verre par exemple), puisque tous les électrons sont déjà dans des orbitales moléculaires liantes. Ils résistent bien aux acides et bases et sont également insolubles.

Du point de vue des propriétés optiques, les solides covalents sont généralement transparents. C'est vrai du verre et du diamant. Pourquoi?
Dans les solides moléculaires et les solides covalents, les liaisons interatomiques dans une molécule sont des liaisons covalentes. Qu'en est-il des solides où la liaison est entièrement ionique, donc des solides construits avec des ions?

![]()

