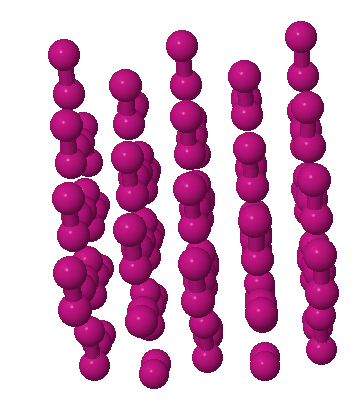Solides moléculaires
Les molécules covalentes possèdent des enthalpies de liaison (en kJ par mole) assez élevées mais des températures de fusion (en °C) très basses.
| H2 |
N2 |
O2 |
| 436 |
944 |
496 |
| -260? |
-210 |
-219 |
| F2 |
Cl2 |
Br2 |
I2 |
| 158 |
242 |
193 |
151 |
| -218 |
<-34 |
-7 |
114 |
| HF |
HCl |
HBr |
HI |
| 565 |
431 |
366 |
299 |
| -83 |
-112 |
-86 |
-51 |
S8
(soufre) |
C20H42
(eicosane) |
C30H62
(n-triacontane) |
C6H12O6
(glucose) |
| 113 |
37 |
66 |
150 |
Les enthalpie de liaison élevées reflètent la solidité de la liaison covalente, particulièrement pour les liaisons triples (N2), tandis que les faibles températures de fusion montrent que les molécules dans le solide sont retenues par des interactions faibles, les forces de van der Waals. Un solide moléculaire est donc une collection de molécules distinctes; la cohésion est forte entre atomes de la même molécule, mais généralement faible entre les molécules.
On note que le point de fusion augmente lorsque la taille de la molécule augmente. C'est le cas de HI, du soufre S (qui existe en fait à l'état solide sous la forme de molécules de formule S8, des paraffines CnH2n+2 ou encore du glucose. Cela reflète l'augmentation des forces de van der Waals lorsque le nombre d'électrons, donc la polarisabilité, augmente. Une contribution due à des liaisons hydrogène s'ajoute parfois (HF, glucose).
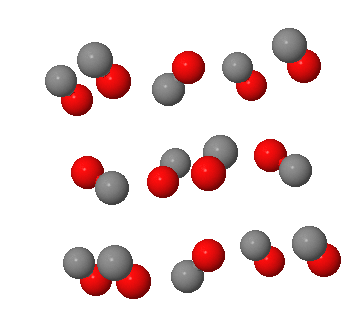
Exemples de solides moléculaires
Pour une représentation interactive, cliquez sur l'image.
I2 | CO |
 |
 |
Autres propriétés des solides moléculaires
La faible cohésion offerte par les forces de van der Waals rendent les solides moléculaires en général solubles dans des solvants de polarité voisine de celle de la molécule. Ainsi le glucose est soluble dans l'eau, tandis que les paraffines sont solubles dans les solvants non-polaires.

![]()