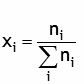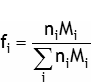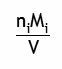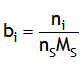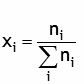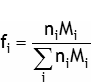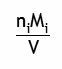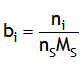Expression de la composition d'un mélange ou d'une solution
On considère un mélange de n1 moles d'une substance 1 de masse molaire M1, n2 moles d'une substance 2 de masse molaire M2, n3 moles d'une substance 3 de masse molaire M3, etc.
Pour définir complétement la composition du mélange, il suffit en principe de connaitre le nombre de mole de chacun des constituants. En pratique, cependant, on préfère souvent utiliser d'autres mesures de la composition. C'est le cas par exemple lorsque le mélange est une solution, c'est-à-dire un liquide de volume total V avec un constituant majoritaire, le solvant S.
Parmi les mesures de la composition d'un mélange, on utilise fréquemment:
| | | Unités usuelles |
| Fraction molaire | 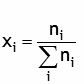 | nombre sans dimension
exprimé souvent en % |
| Fraction massique | 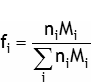 | nombre sans dimension
exprimé souvent
en %, ppm ou ppb |
| Concentration massique | 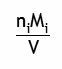 | g/L ou mg/L |
Molarité
(ou concentration molaire) |  | moles/L (symbole M) |
| Molalité | 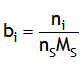 | moles/kg (symbole m) |
Illustrations
i.1
Qu'est-ce qui justifie l'utilisation de la molalité? Quel avantage présente-t-elle par rapport à la molarité par exemple?
i.2
Quelle est la molarité des ions hydrogénocarbonates [HCO
3¯] dans l'eau en bouteille Naya? Calculez la molalité de la solution. Quelles hypothèses doit-on faire? Discutez la différence entre les deux valeurs.
 cliquer sur l'image pour voir la composition de l'eau
4.10 mM; 4.11×10-3m
cliquer sur l'image pour voir la composition de l'eau
4.10 mM; 4.11×10-3m
i.3
Quelle masse de saccharose C12H22O11 doit-on dissoudre dans 100 g d'eau pour obtenir une fraction molaire de 12.4%?
269 g
i.4
La solubilité (c'est-à-dire la quantité maximum que l'on peut dissoudre) de l'heptanol CH3(CH2)6OH (M = 116.2024 g.mol-1) dans l'eau à 20°C est 1.8370 g.L-1. Calculez la molarité, la molalité et la fraction molaire de la solution saturée, dont la masse volumique est 0.99652 g.cm-3?
0.015809 M; 0.015893 m; 0.028623 %
i.5
Une solution aqueuse de nitrate d'argent AgNO3 (M = 169.874 g.mol-1) à une fraction massique de 21.90% possède une masse volumique de 1.220 g.cm-3. Quelle masse de cette solution doit-on ajouter à de l'eau pure pour préparer 150.0 mL d'une solution 0.200M?
23.27 g