La liaison hydrogène
Certains composés dont les interactions principales sont de type van der Waals présentent des températures de vaporisation plus élevées que ne le laissent prédire leur moment dipolaire et leur polarisabilité. Par exemple, c'est le cas de l'eau H2O, de l'ammoniac NH3 ou encore des molécules contenant un groupement acide carboxylique COOH. Par exemple pour les composés H2X ou X est un des éléments de la famille des chalcogènes (groupe 16):
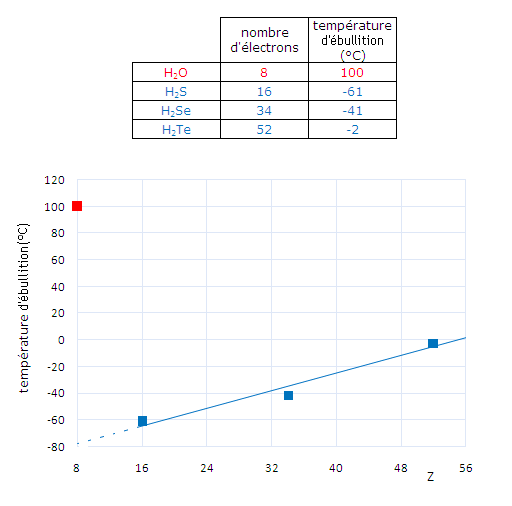
Un effet similaire est observé pour les température de fusion: un solide avec des liaisons hydrogène entre molécules fond à plus haute température.
Les interactions dans ces molécules comprennent une contribution additionnelle; Il s'agit d'une interaction dipole-dipole dirigée, c'est-à-dire qui n'agit que dans une certaine direction. Dans l'eau, par exemple:
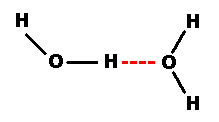
Cette interaction est plus forte que les autres forces de van der Waals (quelques dizaines de kJ/mole). On l'observe uniquement entre l'hydrogène impliqué dans une liaison OH, NH ou HF, d'une part, et O, N ou F, d'autre part. La liaison hydrogène est responsable de la masse volumique plus faible de la glace par rapport à l'eau liquide à 0°C. Elle joue par ailleurs un rôle central dans les molécules responsable de la vie, par exemple:



