
Hydrogénations énantiosélectives par catalyse hétérogène
Marc-André Laliberté, Vincent Demers-Carpentier, Stéphane Lavoie,
Gautier Mahieu
Réactions de métathèses catalysées par le b-Mo2C
Israel Temprano,
Nathalie Dubuc, Mohamed Siaj
Mécanisme
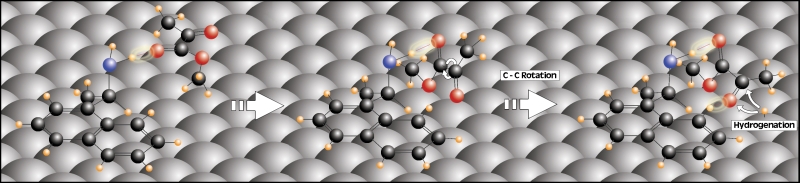
de la réaction d'Orito - Hydrogénation énantiosélective par catalyse hétérogène
Le terme « chiral »
vient du mot grec cheir qui veut dire « main ». La main gauche et la main droite
sont des entités chirales puisqu’il est impossible de les superposer l’une sur
l’autre, des images miroirs en d’autres termes. Ainsi, le seul récepteur
approprié pour la main gauche serait un gant gauche. Dans le monde de
l’infiniment petit, maintes molécules sont présentes en sous leurs deux formes
miroirs, appelées des énantiomères (R) et (S). (R) signifie rectus (droit) et
(S) signifie sinister (gauche). Un mélange de 50 % (R) et 50 % (S) d’une
molécule est un mélange dit racémique. Un produit qui est 100 % (S) ou 100 % (R)
est dit énantiomèriquement, ou optiquement, pur.
La chiralité prend
toute son importance dans le corps humain où les divers récepteurs y sont
extraordinairement sensibles. Par exemple, les énantiomères (R) et (S) du
carvone présentent des odeurs différentes : menthe verte et cumin. Ceci nous
indique que le sens de l’odorat fait intervenir des récepteurs chiraux. L’acide
lactique qui fait mal aux muscles est l’image miroir de l’acide lactique trouvé
dans le lait. L’énantiomère d’une molécule peut être digérée tandis que l’autre
sera rejetée sans être assimilée par le corps. Le dextrose est moins néfaste
pour les personnes diabètes que son image miroir, le lévulose. Dans certains
cas, un énantiomère d’un médicament peut avoir un effet thérapeutique tandis que
l’autre peut avoir des effets les plus nocifs. De plus, les propriétés
pharmacinétiques (absorption, distribution, biotransformation et excrétion) sont
fonction de la chiralité d’un médicament.
Les directives de
le FDA (Food and Drug Administration) forcent l’industrie pharmaceutique vers la
production des médicaments qui sont énantiomèriquement purs. Plus précisément,
il faut que la bioactivité du médicament soit connue pour les deux
énantiomères. En conséquence, une industrie pharmaceutique pourrait prolonger la
protection de ses droits sur une drogue simplement en remplaçant un produit
racémique par le même produit en forme énantiomèriquement pur. En 2004, les
quatres médicaments les plus vendus furent le Liptor (12.0 milliards$), le Zocor
(5.9 milliards$), le Plavix (5.0 milliards$) et le Nexium (4.8 milliards$), tous
étant des énantiomères. Plus des deux tiers des médicaments couramment en
développement sont énantiomèriquement purs.
On peut facilement
conclure que l’avenir de l’industrie pharmaceutique, un des secteurs clés de
l’économie Québécoise, est fortement liée à la synthèse de médicaments
énantiomèriquement purs.
Les défis posés par ce virage obligatoire vers des produits énatiomériquement
purs sont énormes et multiples. D’abord, il faut faire la synthèse asymétrique,
c'est-à-dire la synthèse qui mène à un seul énantiomère plutôt qu’un mélange
racémique. Ce défi fait appel à la catalyse.
En 1979, Orito et al. ont publié leur recherche faisant état d’une réaction de
catalyse hétérogène énantiosélective pour l’hydrogénation des
a-cétoesters
sur une surface de platine modifiée chiralement. Aujourd’hui, cette réaction
donne des productions de l’ordre du kilogramme avec des excès énantiomériques
atteignant plus de 97,5% dans certains cas. Malgré ces faits encourageants, le
mécanisme est toujours un sujet de débat intense dans la communauté scientifique
malgré les multiples recherches à ce jour effectuées. Une connaissance
approfondie du mécanisme permettrait d’étendre ses principes pour développer
davantage de systèmes de catalyse hétérogène efficaces dans la synthèse
asymétrique, étant donné la demande toujours grandissante de produits
optiquement purs et le nombre très restreint de ces systèmes. L’avantage de
ce type de réactions sur la catalyse homogène provient directement du catalyseur
qui constitue à lui seul une phase dans le système. Ceci implique une phase de
séparation beaucoup plus facile et une toxicité moindre, ce qui permet une
économie substantielle pour les industriels.
Les informations à
trouver pour résoudre le mécanisme de la réaction d’Orito sont très nombreuses.
Ce système est très complexe étant donné le nombre de composants interagissant
dans la chambre réactionnelle. Le système est composé du catalyseur (platine
supporté par l’alumine), du modificateur adsorbé sur le catalyseur (dérivés
d’alcaloïdes), du réactif (a-cétoesters
ou autres cétone activées), du solvant (ex. : toluène, chloroforme), du produit
formé (lactates ou alcools) et de l’hydrogène. Diverses stratégies sont
utilisées par plusieurs groupes de chercheurs à travers le monde pour tenter de
connaître la nature des diverses interactions entre les composants. Ces champs
d’études peuvent être groupés en quatre catégories : les calculs théoriques, les
études spectroscopiques in situ, les études intrinsèques en catalyse et
les études sous ultra-haut vide (UHV).
Les calculs théoriques
permettent de fournir une information précise et localisée de la surface sans
les conditions « réelles » grâce entre autres à des analyses conformationnelles
entre différents composants. Ces informations servent aussi à appuyer les
résultats expérimentaux.
Les résultats des études
spectroscopiques in situ en ATR-IR donnent une
information sur la géométrie d’adsorption du modificateur dans les conditions de
la réaction d’Orito. Ces études offrent de belles perspectives concernant les
études de réactions catalytiques puisqu’elles permettent une étude
vibrationnelle en milieu réactionnel.
Les études intrinsèques
en catalyse donnent quant à elles des données expérimentales concernant l’effet
des composants sur la cinétique de la réaction. Ceci permet entre autres de
développer et faire des essais avec de nouveaux modificateurs. En ayant cette
information, il est aussitôt possible de faire des études plus en profondeur
grâce aux calculs théoriques et aux études UHV.
Les études UHV, telles
que réalisés dans notre laboratoire, ont pour
avantage de donner des informations sur l’orientation des molécules ainsi que
sur les diverses interactions à la surface du catalyseur. Ces informations
clés sont critiques pour la recherche du mécanisme tel que le démontre nos
récentes études qui ont d’ailleurs permises de proposer un nouveau mécanisme
d’hydrogénation énantiosélective pour la réaction d’Orito. Ce mécanisme
donne une explication sur le rôle du métal en même temps que sur
l’énantiodifférentiation, ce qui le différencie des précédents mécanismes
proposés. À ce jour, peu d’études ont été effectuées sur des systèmes à vide.
Jusqu'à maintenant, nos contributions furent
d'abord de soumettre le nouveau mécanisme impliquant une liaison hydrogène entre
l'amine du modificateur et le groupement ester du pyruvate de méthyle (et non le
groupement cétonique à être hydrogéné) ainsi qu'une seconde liaison hydrogène
entre le groupement cétonique et le cycle aromatique qui sert aussi d'ancrage au
modificateur. Ces premiers résultats furent basés sur des études RAIRS et TPD.
Nous avons ensuite démontré la pertinence d'une liaison hydrogène avec les
hydrogènes du cycle aromatique par des études de coadsorption avec le benzène et
avec le toluène, par RAIRS et TPD. Des études en catalyse réelle sont aussi en
cours. Des études comparatives avec le Pt(111) et le Ni(111) ont aussi permit
d'éclaircir le rôle de la surface dans le mécanisme d'hydrogénation. Des
études HREELS à venir permettront davantage de comprendre ce phénomène de
surface particulier en plus de confirmer la présence de l'importante liaison
hydrogène entre les cycles aromatiques et le substrat. Finalement, notre
installation STM permet déjà d'obtenir de très bonnes images qui apportent des précisions sur l'adsortion des substrats et leur
coadsorption avec des molécules aromatiques.
À venir...


