Énoncé
- Expliquer pourquoi, dans une période donnée, par exemple du sodium Na à l'argon Ar, l'énergie de première ionisation I1 tend à augmenter.
- Malgré cette tendance, on remarque expérimentalement que I1 diminue du phosphore (I1=1060 kJ.mol-1) au soufre (I1=1005 kJ.mol-1). Expliquer pourquoi.
Solution
- L'énergie de première ionisation I1 est l'énergie qu'il faut donner à un élément pour lui arracher un électron. I1tend à augmenter en parcourant une période (voir la variation de I1 avec Z) à cause de l'augmentation de la charge apparente du noyau. En effet, considérons pour simplifier les éléments de la troisième période entre l'aluminium (Z=13) et l'argon (Z=18). Augmenter Z consiste dans ce cas à ajouter un proton au noyau (ce qui augmente sa charge réelle de 1) et un électron sur une orbitale 3p. Puisque la probabilité de présence en fonction de la distance au noyau est la même pour tous les électrons 3p, l'effet d'écran reste constant pour tous ces électrons. Par conséquent, la charge apparente du noyau (cèst-à-dire la charge réelle moins l'effet d'écran) augmente lorsque Z augmente. Cette augmentation de la charge apparente fait subir aux électrons 3p une attraction plus forte, ce qui diminue leur énergie potentielle, contribuant ainsi à diminuer leur énergie totale. Ce phénomène, qui explique aussi pourquoi l'énergie de n'importe quelle orbitale diminue lorsque Z augmente, conduit à une augmentation de I1 avec Z.
- Malgré la tendance générale de I1, qui augmente avec Z, on remarque expérimentalement une anomalie: I1 diminue du phosphore (I1=1060 kJ.mol-1) au soufre (I1=1005 kJ.mol-1). C'est aussi le cas dans les autres périodes, par exemple de l'azote à l'oxygène. La raison se trouve dans la présence d'électrons appariés dans la même orbitale p dans le soufre mais pas dans le phosphore:
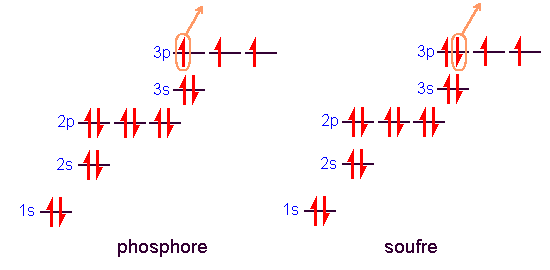
La première ionisation consiste à arracher l'électron de plus haute énergie dans l'atome à l'état fondamental. La charge apparente du noyau subie par les électrons 3p augmente du phosphore au soufre et on s'attend à une augmentation de I1. Une énergie plus faible que prévue est cependant nécessaire pour ioniser le soufre à cause des répulsions entre les deux électrons de la même orbitale.



