Taille des atomes
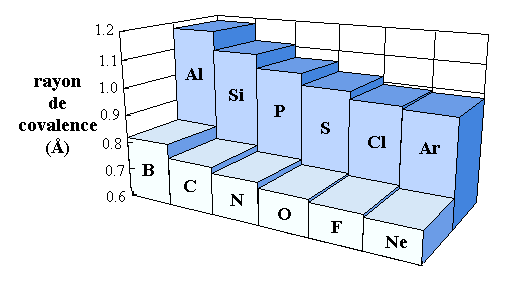
La figure ci-dessous montre le rayon de covalence de quelques éléments.
Expliquer en quelques phrases les tendances observées.
Réponse
Note: il faut ici expliquer les tendances, pas seulement les décrire.
Le rayon de covalence est une mesure de la taille des atomes. La figure montre essentiellement deux tendances:
-
la taille des atomes diminue lorsque Z augmente le long du groupe p d'une période:
-
du bore B ([He] 2s2 2p1) au néon Ne ([He] 2s2 2p6)
- de l'aluminium A
 ([Ne] 3s2 3p1) à l'argon Ar ([Ne] 3s2 3p6)
([Ne] 3s2 3p1) à l'argon Ar ([Ne] 3s2 3p6)
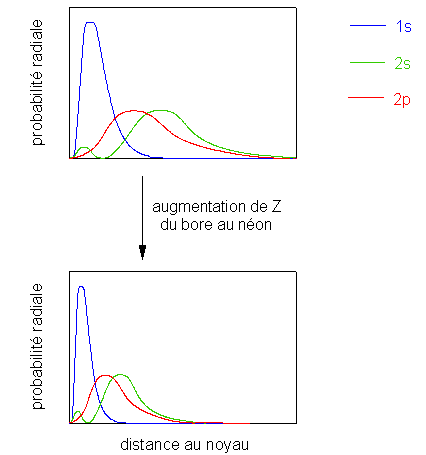
Cette tendance s'explique par l'augmentation de la charge apparente du noyau sur les électrons périphériques. En effet, lorsque Z augmente, la charge réelle du noyau augmente. Un électron est ajouté dans une orbitale p. La probabilité de présence de tous les électrons ainsi ajoutés, du bore au néon ou de l'aluminium à l'argon, est à la même distance du noyau. . Par conséquent, l'effet d'écran ne change pas et l'attraction subie par ces électrons augmente, ce qui diminue la taille de l'atome:
-
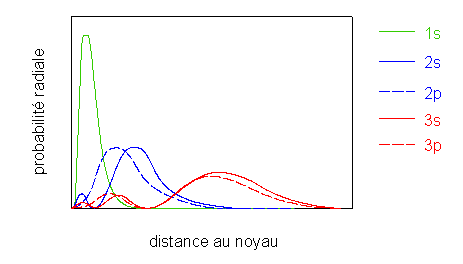
la taille des atomes augmente lorsque Z augmente le long d'une famille, par exemple du bore B ([He] 2s2 2p1) à l'aluminium A
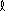 ([Ne] 3s2 3p1)
([Ne] 3s2 3p1)
Cette tendance s'explique par la probabilité de présence des électrons 3s et 3p plus éloignée du noyau que celle des électrons 2s et 2p: