Énoncé
Expliquer pourquoi le fait que les atomes émettent un spectre de raies et non un spectre continu, indique que leur énergie est quantifiée.
Réponse
Une raie est l'onde électromagnétique émise par un atome lorsqu'il perd de l'énergie, c'est-à-dire lorsqu'il évolue d'un état de grande énergie (état excité) à un état de plus faible énergie (état moins excité). On sait que l'énergie transportée par une onde électromagnétique est quantifiée, chaque onde transportant une énergie h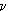 .
.
Le spectre de raies est l'ensemble des ondes électromagnétiques émises par un grand nombre d'atomes lorsqu'ils perdent de l'énergie. Puisqu'on a un grand nombre d'atomes, chacun étant dans un des états excités possibles, le spectre de raies correspond à toutes les transitions possibles entre un état excité et un état de moindre énergie. Le spectre de raies représente donc tous les changements d'énergie possibles pour cet atome.
Si le spectre de raies est continu, c'est-à-dire s'il contient toutes les fréquences 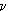 , alors tous les changements d'énergie sont possibles pour l'atome.
, alors tous les changements d'énergie sont possibles pour l'atome.
Si, au contraire (et c'est le cas en réalité) le spectre de raies est discret, c'est-à-dire qu'il ne contient que certaines fréquences, alors seulement certaines transitions sont permises. Cela indique que l'atome ne peut pas posséder toutes les énergies possibles, mais que seulement certaines valeurs sont permises. Autrement dit, l'énergie de l'atome est quantifée.


