Énoncé
- Porter, sur la même échelle d'énergie, les orbitales atomiques des électrons de valence du lithium Li et de l'hydrogène H.
- Décrire les orbitales moléculaires que donne, selon vous, la combinaison linéaire de ces orbitales atomiques: quel en est le nombre, quelle symétrie possèdent-elles et quelle est leur énergie, par rapport à celle des orbitales atomiques parentes?
- Construire le diagramme d'énergie des orbitales moléculaires, en y représentant la configuration électronique de l'état fondamental de la molécule LiH.
- Cette molécule est-elle stable? pourquoi?
Réponse
Le lithium possède un électron de valence dans une orbitale 2s. L'examen de la figure donnant l'énergies des orbitales atomiques en fonction de Z (ci-dessous) indique que cet électron possède une énergie plus élevée que celle de l'électron 1s de l'hydrogène, entre 0.37 à 0.4 fois (-13.59 eV) environ, soit entre -5. et -5.5 eV, comparé à -13.59 eV pour H:
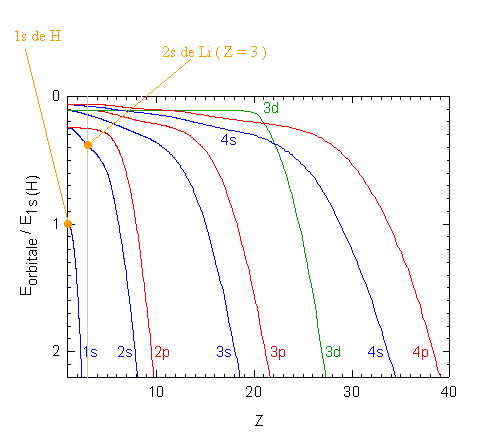
Remarque: on peut aussi consulter le tableau périodique pour connaitre l'énergie de première ionisation, I1. Pour Li, I1 correspond à la transition de l'orbitale 2s jusqu'à une énergie nulle, c'est-à-dire E(2s de LI)=-I1. On trouve ainsi -5.39 eV.
La combinaison linéaire d'une orbitale atomique 2s avec une orbitale atomique 1s donne deux orbitales moléculaires  , une liante, d'énergie inférieure à l'énergie de l'orbitale atomique 1s de H et une antiliante, d'énergie supérieure à l'énergie de l'orbitale atomique 2s de Li:
, une liante, d'énergie inférieure à l'énergie de l'orbitale atomique 1s de H et une antiliante, d'énergie supérieure à l'énergie de l'orbitale atomique 2s de Li:
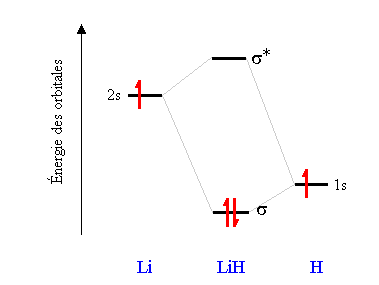
L'ordre de liaison de LiH étant (2-0)/2 = 1.0, la molécule est stable.
Attention: dire que la molécule est stable, dans ce contexte, c'est dire que la molécule LiH est plus stable que les atomes Li et H séparés. Cela ne veut pas dire que LiH est stable dans l'absolu. En fait, bien que l'on puisse préparer au laboratoire l'hydrure de lithium LiH, c'est une molécule extrèmement réactive qui donnera une réaction chimique avec presque toute espèce avec qui elle entre en collision (la paroi du récipient, une autre molécule, etc.). C'est d'ailleurs cette grande réactivité qui en fait l'attrait pour la synthèse.




