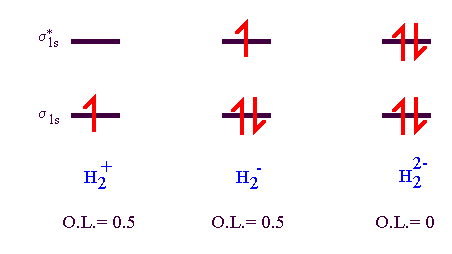Énoncé
Prédire si les espèces diatomiques homonucléaires suivantes sont stables. Pour une série donnée, prédire le classement des espèces par ordre d'énergie de liaison croissante:
a) H2+, H2-, H22-
b) O2+, O2-, O2
Réponse
Pour prédire qu'une molécule diatomique est stable, il faut démontrer que son énergie est inférieure à la somme des énergies des deux atomes séparés. On utilise pour cela le diagramme des énergies des orbitales atomiques et moléculaires, duquel on déduit l'ordre de liaison, O.L.:
où né(liante) et né(antiliante) représentent le nombre d'électrons dans des orbitales moléculaires liantes et antiliantes, respectivement.
Une molécule diatomique est stable si O.L.>0. L'énergie de la liaison est d'autant plus grande que O.L. est grand.
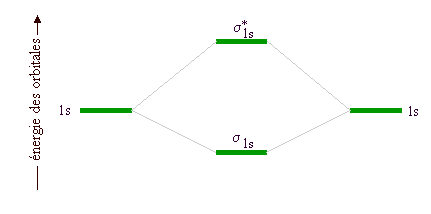
- Le diagramme des énergies orbitalaires des espèces H2+, H2-, H22- fait intervenir les orbitales atomiques 1s dont le recouvrement donne des orbitales moléculaires
 :
ce qui conduit aux diagrammes d'énergie suivants pour les ions considérés ici:
On prédit que H22- n'est pas stable (O.L. = 0), que H2+ et H2- sont stables et possède une énergie de liaison similaire (O.L. égaux).
:
ce qui conduit aux diagrammes d'énergie suivants pour les ions considérés ici:
On prédit que H22- n'est pas stable (O.L. = 0), que H2+ et H2- sont stables et possède une énergie de liaison similaire (O.L. égaux).
-
Le diagramme des énergies orbitalaires des espèces O2+, O2- et O2 fait intervenir les orbitales atomiques 2s et 2p dont le recouvrement donne des orbitales moléculaires
 et
et 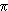 selon:
selon:

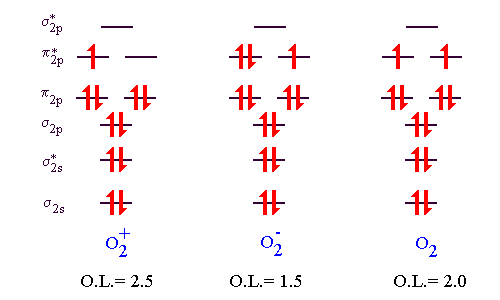
Cela conduit aux diagrammes d'énergie suivants pour les espèces considérées ici:
On prédit que ces trois espèces moléculaires sont stables. Leur classement par ordre croissant d'énergie de liaison (prédit à partir de O.L.) est O2- O2 O2+.