Combinaison linéaire des orbitales atomiques (LCAO)
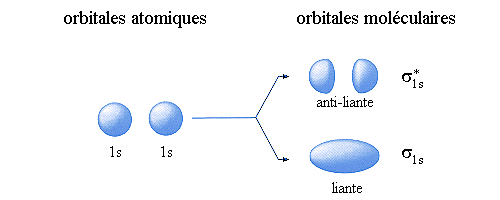
La combinaison linéaire de deux orbitales atomiques s conduit à deux orbitales moléculaires de symétrie cylindrique, appelées  :
:
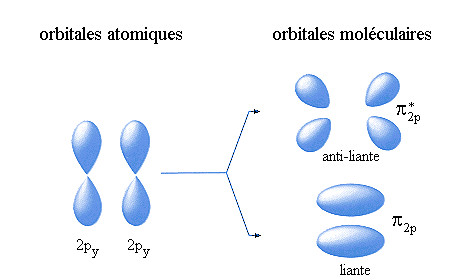
La combinaison linéaire de deux orbitales atomiques p conduit à deux orbitales moléculaires qui peuvent être:
- de symétrie cylindrique (orbitale
 ) si les orbitales atomiques p étaient symétriques par rapport à l'axe passant par les deux noyaux:
) si les orbitales atomiques p étaient symétriques par rapport à l'axe passant par les deux noyaux:
- de symétrie plane (orbitale
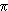 ) dans le cas contraire:
) dans le cas contraire:
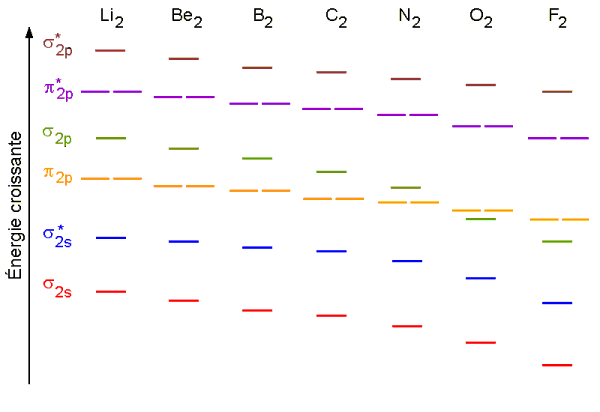
On représente les orbitales moléculaires et les orbitales atomiques qui leur donnent naissance par combinaison linéaire, sur un même diagramme d'énergie schématique. Par exemple pour les molécules diatomiques homonucléaires construites à partir des premiers éléments de la deuxième période:
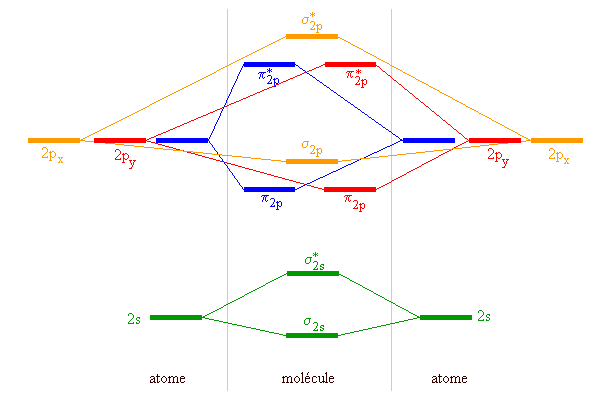
Le diagramme conserve les mêmes caractéristiques pour tous éléments de la période, mais les énergies relatives changent avec la charge du noyau:
On remarque que l'énergie de 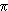 est inférieure à celle de
est inférieure à celle de  du lithium à l'azote, mais l'ordre est inversé à partir de l'oxygène.
du lithium à l'azote, mais l'ordre est inversé à partir de l'oxygène.
 Pour télécharger les images de cette page, en vue d'une impression couleur.
Pour télécharger les images de cette page, en vue d'une impression couleur.