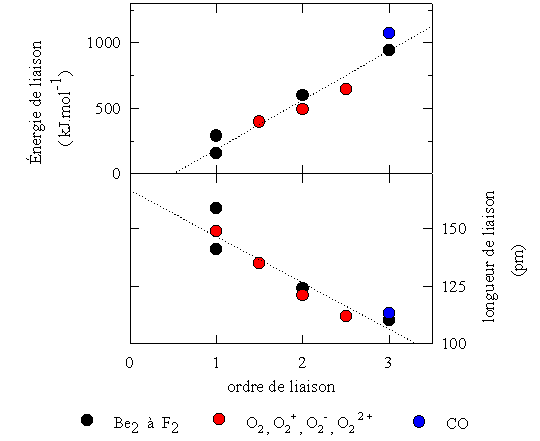
L'ordre de liaison (O.L.) est défini par:

où né (liante) et né (antiliante) représentent le nombre d'électrons dans des orbitales moléculaires liantes et antiliantes, respectivement.
Par exemple, la figure ci-contre montre la configuration électronique de la molécule d'azote N2, représenté sur un diagramme d'énergie des orbitales moléculaires. Dans ce cas, l'ordre de liaison est:
( né(![]() 2s) + né(
2s) + né(![]() 2p) + né(
2p) + né(![]() 2p) - né(
2p) - né(![]() *2s) ) / 2
*2s) ) / 2
= ( 2 + 4 + 2 -2 ) / 2
= 6 / 2 = 3.0