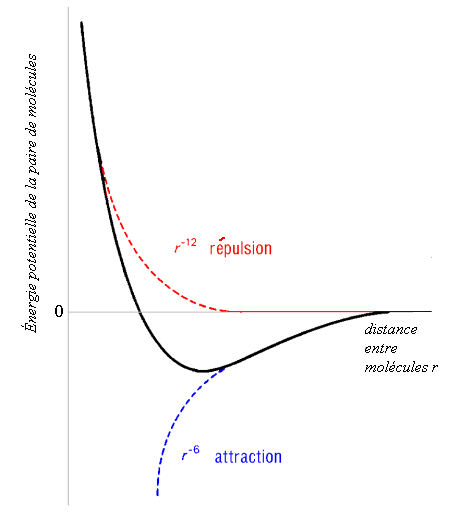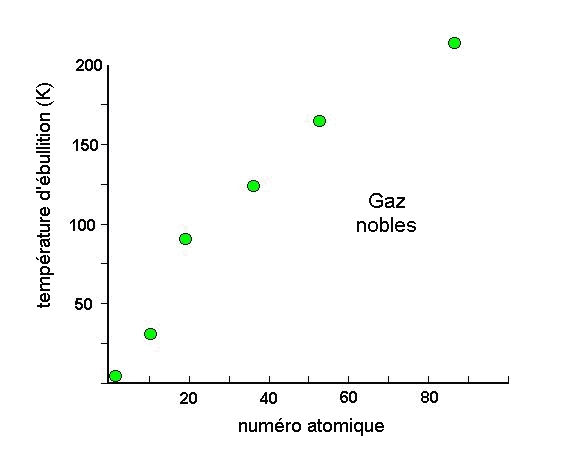
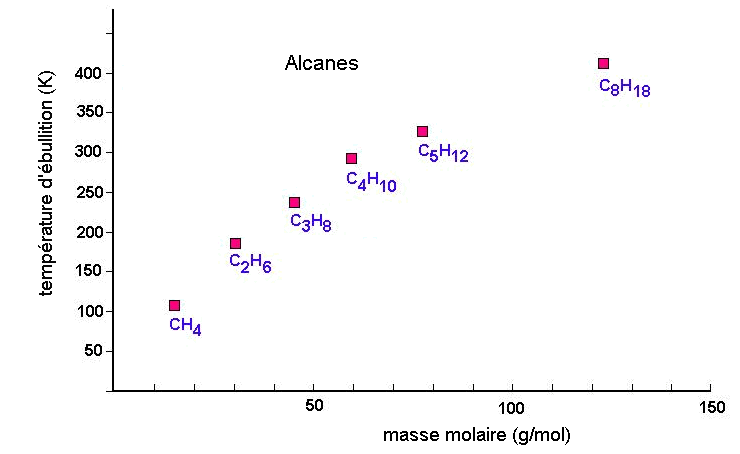
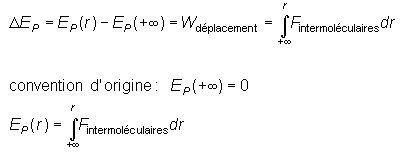
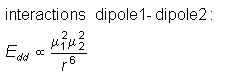
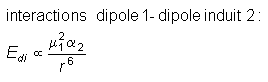

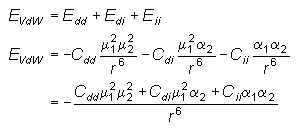
(Å3) |
µ (D) |
Contributions à l'énergie potentielle | Énergie potentielle à une distance de 3Å | Tébullition (°C) |
|||||||
(J.m6.mole-1) |
(J.m6.mole-1) |
(J.m6.mole-1) |
(J.m6.mole-1) |
||||||||
| He | 0.2 | 0 | 0 | 0 | 0.5 | 0.5 | 0 | 0 | -0.01 | -0.01 | -269 |
| Ar | 1.6 | 0 | 0 | 0 | 273 | 273 | 0 | 0 | -3.7 | -3.7 | -186 |
| Xe | 4.0 | 0 | 0 | 0 | 1694 | 1694 | 0 | 0 | -23 | -23 | -108 |
| HCl | 2.6 | 1.1 | 113 | 34 | 734 | 881 | -1.5 | -0.5 | -10.1 | -12.1 | -85 |
| HBr | 3.6 | 0.8 | 37 | 26 | 1411 | 1474 | -0.5 | -0.4 | -19.4 | -20.2 | -66 |
| HI | 5.4 | 0.4 | 2 | 104 | 3105 | 3211 | -0.03 | -1.4 | -42.6 | -44.0 | -36 |
| CCl4 | 10.5 | 0 | 0 | 0 | 10915 | 10915 | 0 | 0 | -150 | -150 | 77 |
| CO | 2.0 | 1.1 | 0.02 | 0.4 | 433 | 433 | -0.0003 | -0.005 | -5.9 | -5.9 | -191 |
| NH3 | 2.2 | 1.5 | 489 | 59 | 527 | 1075 | -7 | -1 | -7 | -15 | 36 |
| H2O | 1.5 | 1.8 | 1120 | 61 | 245 | 1426 | -15 | -1 | -3 | -20 | 100 |