 (car T is fixée, et même w=0=q, car
(car T is fixée, et même w=0=q, car 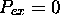 ) , ou le
mélange de deux gaz, ou encore l'équilibrage thermique de deux corps en
contact, etc.
) , ou le
mélange de deux gaz, ou encore l'équilibrage thermique de deux corps en
contact, etc.
La première loi de la thermodynamique est un principe de conservation
d'énergie. Elle établit des contraintes énergétiques sur des
processus permis (reliant des états d'équilibre ou états
thermodynamiques). Elle ne fournit aucune information sur la
directionalité naturelle des processus. Cette directionalité
relève de la seconde loi qui, au lieu d'être un principe de
conservation, est un principe variationel, c.à d. qu'elle demande
l'optimisation d'une certaine grandeur physique, l'entropie, qui sera
définie bientôt comme une nouvelle fonction d'état mesurant le
désordre dans un système thermodynamique. L'idée que
l'évolution naturelle et spontanée des processus tend à
favoriser un degré maximal de désordre est suggérée par
l'examen d'un processus irréversible simple quelconque, tel que la
détente isotherme d'un gaz parfait dans le vide pour laquelle  (car T is fixée, et même w=0=q, car
(car T is fixée, et même w=0=q, car 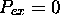 ) , ou le
mélange de deux gaz, ou encore l'équilibrage thermique de deux corps en
contact, etc.
) , ou le
mélange de deux gaz, ou encore l'équilibrage thermique de deux corps en
contact, etc.
Le raisonnement aboutissant à la distribution de Maxwell-Boltzmann donné au Chapitre 1 fait aussi ressortir le caractère privilégié d'un état de plus grand désordre par rapport à des états plus ordonnés. Il existe ainsi deux définitions de l'entropie, l'une dite ``thermodynamique'' et n'employant que des quantités thermodynamiques (chaleurs et température), l'autre dite ``statistique'' et faisant appel aux concepts de mécanique statistique du Chapitre 1. Les deux définitions sont équivalentes, bien entendu, comme on le verra à la fin de la section suivante.