
Aufbau
Les prédictions de l'équation de Schrödinger en matière d'énergie permises pour les électrons d'un atome polyélectronique neutre en fonction de Z (confirmées par les mesures expérimentales)peuvent être représentées graphiquement:
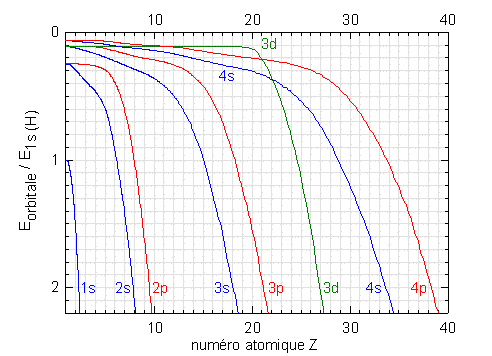

La figure donne les énergies des orbitales lorsqu'on ajoute un électron et un proton à un atome neutre de numéro atomique (Z-1) pour former l'atome neutre de numéro atomique Z.
Ces résultats permettent de reconstruire théoriquement le tableau de la classification périodique des éléments.
Outre le principe d'exclusion de Pauli, cette construction («aufbau») s'appuie sur les règles suivantes:
- laissé à lui-même, tout système (un atome par exemple) tend spontanément à atteindre une énergie minimum;
- à énergie égale, la configuration de l'atome est celle qui minimise les répulsions entre électrons (règle de Hund);
Exemple: le carbone
Par exemple, l'ordre des énergies des orbitales pour Z=6:
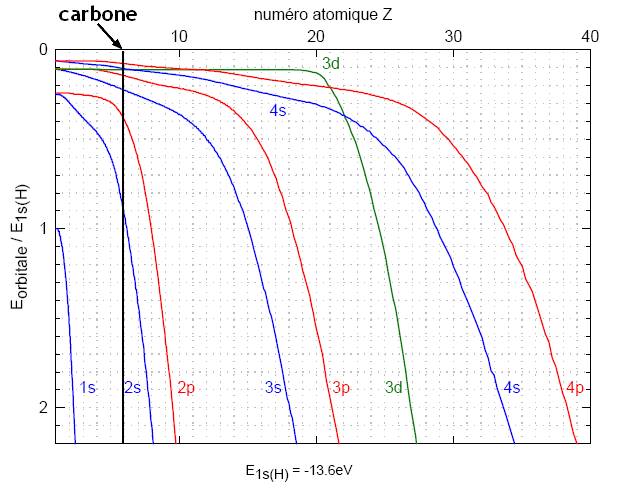
permet de prédire pour le carbone la configuration électronique:
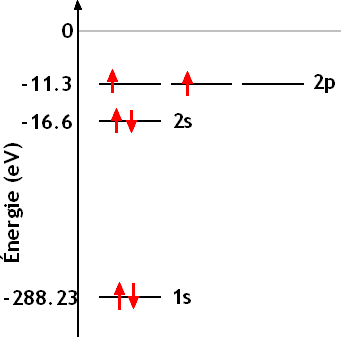
que l'on écrit 1s2 2s2 2p2.
Exemple: le phosphore
Pour le phosphore (Z=15), on a:
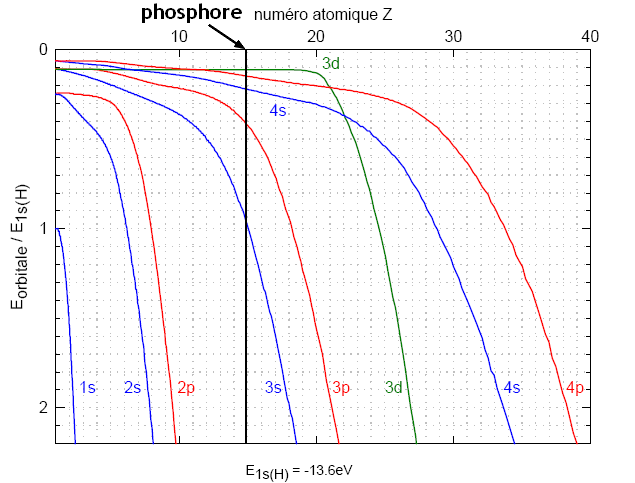
qui conduit à:
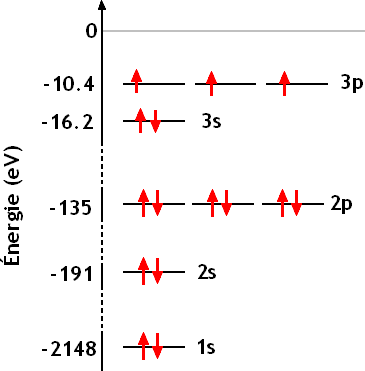
qui s'écrit 1s2 2s2 2p6 3s2 3p3 ou encore [Ne]3s2 3p3.
Illustrations
i.1
Quelle énergie faut-il fournir à un atome de carbone neutre C (Z=6) pour lui arracher un électron 1s? Quelle est la longueur d'onde de la radiation qui fournit cette énergie?
+288.23 eV; 4.305 nm
i.2
Pour placer des atomes neutres de sodium Na (Z=11) dans leur premier état excité, il faut l'irradier avec une onde électromagnétique de longueur d'onde égale à 583.3 nm. Dans quelle orbitale déplace-t-on l'électron? Quelle est l'énergie de cette orbitale?
3p; -3.014 eV
Ordre de remplissage des orbitales — Couche externe d'un atome
À partir de Z=18, l'électron de plus haute énergie à l'état fondamental dans un atome neutre en fonction de Z est dans l'orbitale:
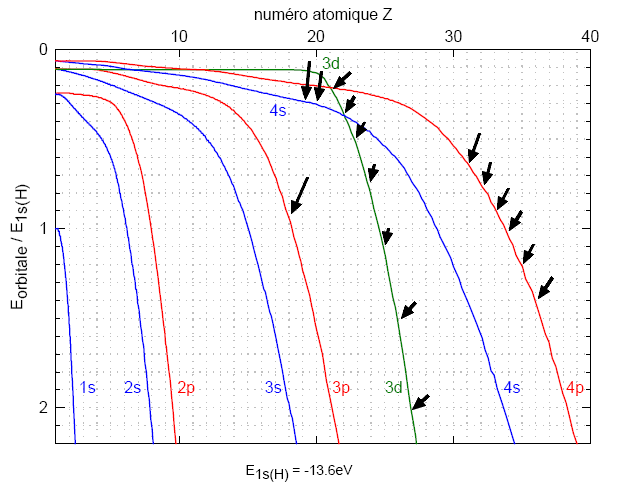
Les orbitales 3d sont donc remplies après 4s mais avant 4p.
Si on construit un tableau de classification des éléments neutres à l'état fondamental, en ordre croissant de numéro atomique, dans lequel:
- chaque ligne (appelée période) contient les éléments dont l'électron de plus haute énergie est dans une orbitale de même nombre quantique n,
- chaque colonne (appelée famille) contient les éléments dont l'électron de plus haute énergie est dans une orbitale de même nombre quantique l, m et s
Le tableau obtenu possède la forme suivante:
| 1s |
|
|
|
1s |
| 2s |
2s |
2p |
2p | 2p | 2p | 2p | 2p |
| 3s |
3s |
3p |
3p |
3p |
3p |
3p |
3p |
| 4s |
4s |
3d |
3d |
3d |
3d |
3d |
3d |
3d |
3d |
3d |
3d |
4p |
4p |
4p |
4p |
4p |
4p |
De la même manière, les orbitales 4d sont remplies après 4s mais avant 4 p:
| 1s |
|
|
|
1s |
| 2s |
2s |
2p |
2p | 2p | 2p | 2p | 2p |
| 3s |
3s |
3p |
3p |
3p |
3p |
3p |
3p |
| 4s |
4s |
3d |
3d |
3d |
3d |
3d |
3d |
3d |
3d |
3d |
3d |
4p |
4p |
4p |
4p |
4p |
4p |
| 5s |
5s |
4d |
4d |
4d |
4d |
4d |
4d |
4d |
4d |
4d |
4d |
5p |
5p |
5p |
5p |
5p |
5p |
Les orbitales 4f sont remplies après 4s mais avant 5d:
| 1 |
1s |
|
|
|
1s |
| 2 |
2s |
2s |
2p |
2p | 2p | 2p | 2p | 2p |
| 3 |
3s |
3s |
3p |
3p |
3p |
3p |
3p |
3p |
| 4 |
4s |
4s |
|
3d |
3d |
3d |
3d |
3d |
3d |
3d |
3d |
3d |
3d |
4p |
4p |
4p |
4p |
4p |
4p |
| 5 |
5s |
5s |
|
4d |
4d |
4d |
4d |
4d |
4d |
4d |
4d |
4d |
4d |
5p |
5p |
5p |
5p |
5p |
5p |
| 6 |
6s |
6s |
4f |
4f |
4f |
4f |
4f |
4f |
4f |
4f |
4f |
4f |
4f |
4f |
4f |
4f |
5d |
5d |
5d |
5d |
5d |
5d |
5d |
5d |
5d |
5d |
6p |
6p |
6p |
6p |
6p |
6p |
| 7 |
7s |
7s |
5f |
5f |
5f |
5f |
5f |
5f |
5f |
5f |
5f |
5f |
5f |
5f |
5f |
5f |
6d |
6d |
6d |
6d |
6d |
6d |
6d |
6d |
6d |
6d |
7p |
7p |
7p |
7p |
7p |
7p |
Globalement, les orbitales sont remplies en ordre croissant de valeur de (n+l), et en cas de valeur égale de (n+l), en ordre croissant de n. Pour se souvenir de l'ordre de remplissage, on peut aussi utiliser:
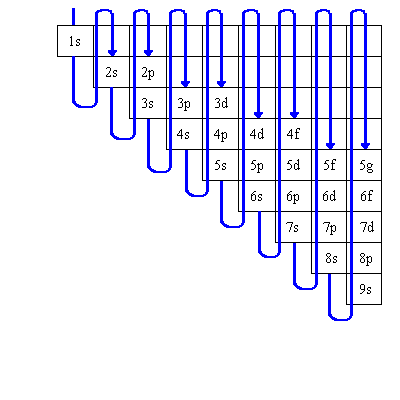
Une des conséquences de cet ordre de remplissage est que la couche externe de l'atome, celle de nombre quantique n le plus grand, celle où se trouve le plus probablement les électrons les plus éloignés et de plus haute énergie, contient tout au plus 8 électrons: 2 dans ns et 6 dans np. On appelle cette couche la couche de valence.








