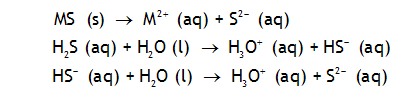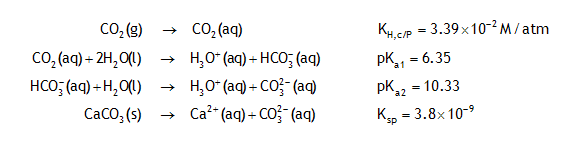Effet du pH sur la solubilité des solides
Solubilité des hydroxydes métalliques
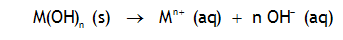
Exemple:
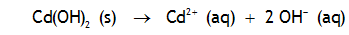
Le produit de solubilité des hydroxides varie considérablement avec la nature de l'ion métallique. La soude NaOH est extrèmement soluble, alors que les hydroxydes de plutonium, par exemple, sont très peu solubles:
| |
Ag+ | Cd2+ | Fe2+ | Fe3+ | Th4+ | Pu4+ |
| pKsp | 7.4 | 14.1 | 16.3 | 38.55 | 50.7 | 62.5 |
Illustration
i.1
Calculez la solubilité de l'hydroxyde de thorium (a) dans l'eau pure (b) dans une solution de pH=5.2. On négligera les effets de force ionique.
(a) 2.0×10-23M; (b) 3.2×10-16M
Solubilité des sulfures métalliques
La solubilité des sulfures métalliques est en général très faible, comme le montrent leurs produits de solubilité.
La solubilité dépend cependant fortement du pH, comme le montre la démonstration détaillée.
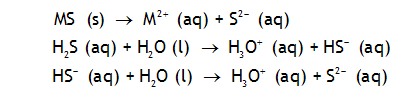
Illustration
i.2
Calculez la solubilité du sulfure de plomb à pH=7 et à pH=4. Expliquez la difference observée.
7.98×10-9 M à pH=7 et 5.80×10-6 M à pH=4.
i.3
À l'aide du diagramme pC-pH pour une solution saturée de sulfure de fer, déterminez:
- le produit de solubilité de FeS;
- les constantes d'acidité de H2S et HS¯;
- les constantes de basicité de S2¯ et HS¯;
- la solubilité dans l'eau initialement pure et le pH de la solution obtenue;
- la solubilité à pH = 6;
- dans quel domaine de pH la solubilité est supérieure à 1 M.
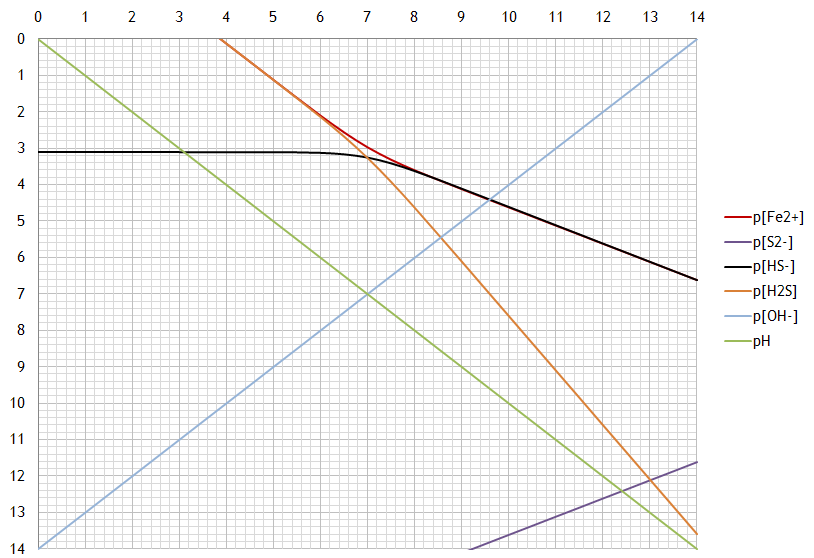
d) 10-4.4M, pH=9.6
Solubilité des carbonates
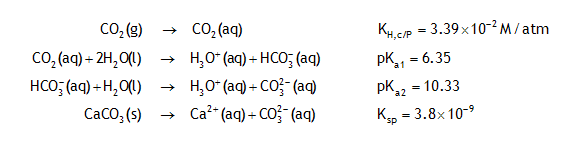
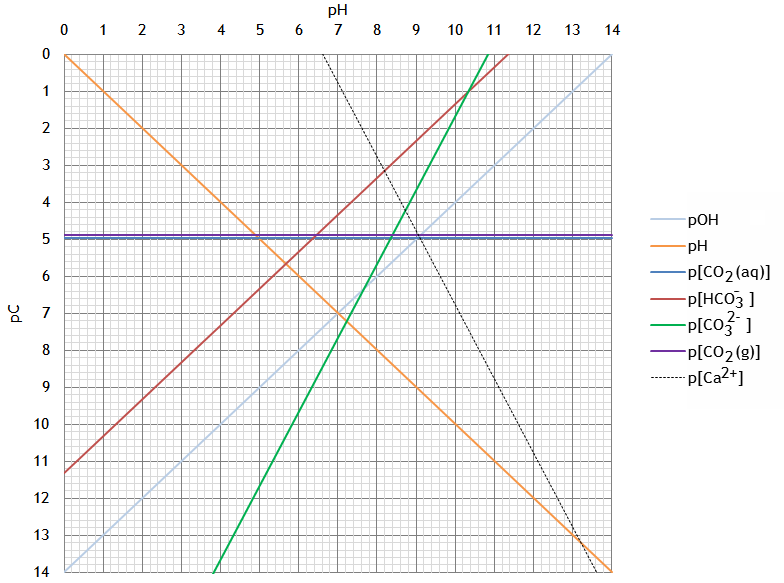
Cas d'une solution aqueuse saturée en CaCO3, en équilibre avec CO2 atmosphérique (PCO2=10-3.5atm)
Illustration
i.3
Quel est le pH d'une eau initialement pure en équilibre à la fois avec l'atmosphère et avec CaCO3 (s) en excès? Quelles sont alors les valeurs de cT, la concentration totale en carbonates dans la solution, et de s, la solubilité du carbonate de calcium ?
pH≈8.3; cT≈10-3M; s≈10-3.4M

![]()
![]()
![]()