![]()

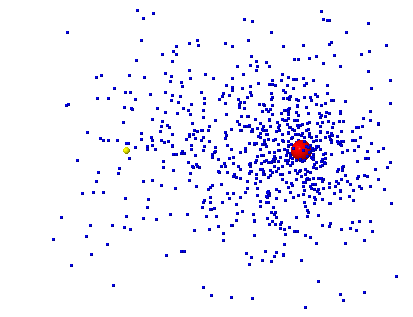
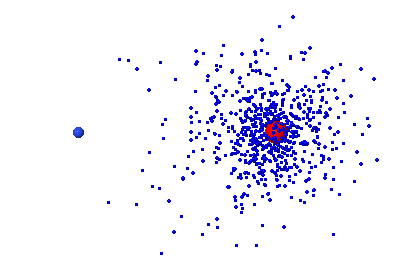
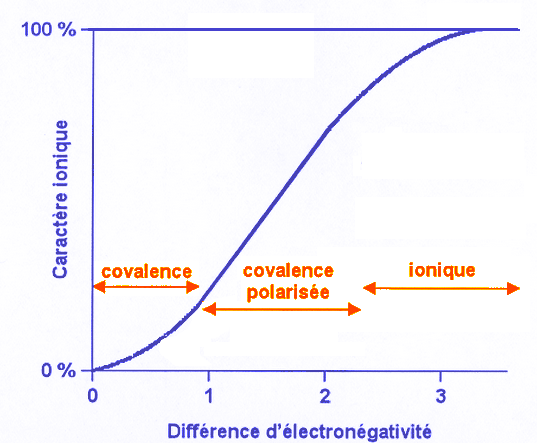
| Molécule |
Partage des
électrons |
Nature de la liaison
dans la molécule |
Interactions
dans le solide |
Température
de fusion (°C) |
Type de
solide |
| F2 | égal | covalente pure |
très faibles (entre molécules non polaires) |
-218 |
solide
moléculaire |
| HF | inégal | polaire |
faibles (entre molécules polaires) |
-83 |
solide
moléculaire |
| LiF | aucun | ionique |
fortes (entre anions et cations) |
848 |
solide
ionique |