![]()
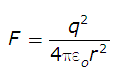

XY (solide ionique) → Xn+ (g) + Yn- (g)
est l'énergie du réseau cristallin, l'énergie réticulaire.

|
Premier exemple Calculez l'énergie réticulaire de NaCl:
Calculez l'énergie réticulaire de l'oxyde de magnésium MgO, connaissant les changements d'énergie suivants:
|
| LiF | LiCl | LiBr | LiI |
| 1046 | 861 | 818 | 759 |
| 848 | 610 | 552 | 469 |
| NaF | NaCl | NaBr | NaI |
| 929 | 787 | 751 | 700 |
| 996 | 801 | 747 | 660 |
| KF | KCl | KBr | KI |
| 826 | 717 | 689 | 645 |
| 858 | 771 | 734 | 681 |
| AgF | AgCl | AgBr | AgI |
| 971 | 916 | 903 | 887 |
| 435 | 455 | 430 | 558 |
| MgO | CaO | SrO | BaO |
| 3850 | 3461 | 6283 | 3114 |
| 2830 | 2900 | 2530 | 1973 |
| MgS | CaS | SrS | BaS |
| 3406 | 3119 | 2974 | 2832 |
| >2000 | 2400 | >2000 | 2230 |
Source: http://www.webelements.com/