
La liaison métallique
Une liaison chimique est le résultat de la combinaison linéaire de fonctions d'onde (ou orbitales) des atomes. Deux orbitales atomiques donnent deux orbitales moléculaires:
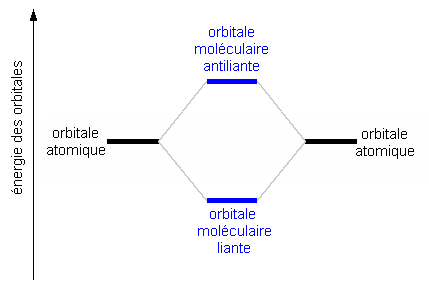
Par exemple, la molécule Na2 peut être décrite par le diagramme d'énergie schématique suivant:
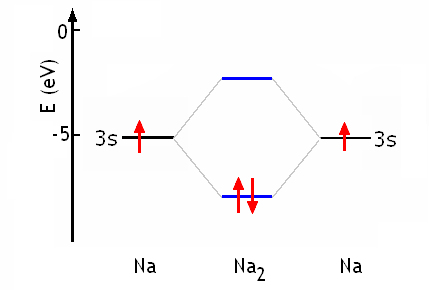
Il existe des situations où les orbitales moléculaires resultent de la combinaison linéaire d'un plus grand nombre d'atomes. Dans le benzène par exemple, 6 orbitales atomiques 2p (un de chaque atome de carbone) conduisent à 6 orbitales moléculaires, dont certaines couvrent la molécule entière.
De façon générale le recouvrement de plusieurs orbitales atomiques conduit à un nombre égal d'orbitales moléculaires. Par exemple la combinaison linéaire de n orbitales 3s du sodium pour donner les molécules Nan (avec n = 2, 3, 6, 13 par exemple) conduit à n orbitales moléculaires:
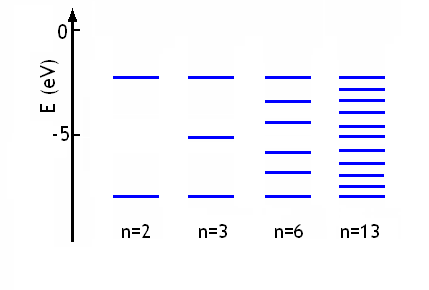
On note que l'énergie de toutes les orbitales moléculaires se situe dans le même domaine, limité par les énergies des deux orbitales moléculaires σ et σ* obtenues si on combine deux orbitales atomiques seulement. Par conséquent, lorsque le nombre d'atomes impliqués dans le recouvrement augmente, la distance entre niveaux d'énergie permis diminue. Dans le métal, le nombre d'atome est considérablement plus grand que 3, 6 ou 13; il est de l'ordre du nombre d'Avogadro. C'est donc le recouvrement de 1020 - 1025 orbitales atomiques qu'il faut considérer. Les énergies des 1020 - 1025 orbitales moléculaires obtenues sont extrêmement proches, si proches en fait que tous les niveaux sont confondus et on a formé une bande continue d'énergies permises:
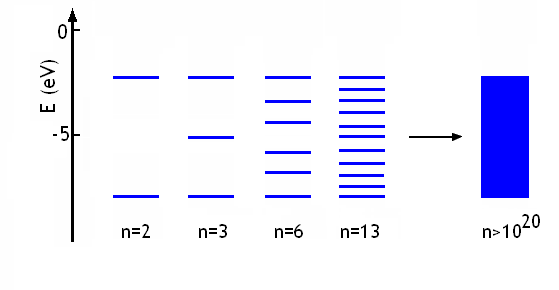
La hauteur de cette bande permise dépend de la distance entre atomes. Il existe une distance donnant le minimum d'énergie aux atomes:
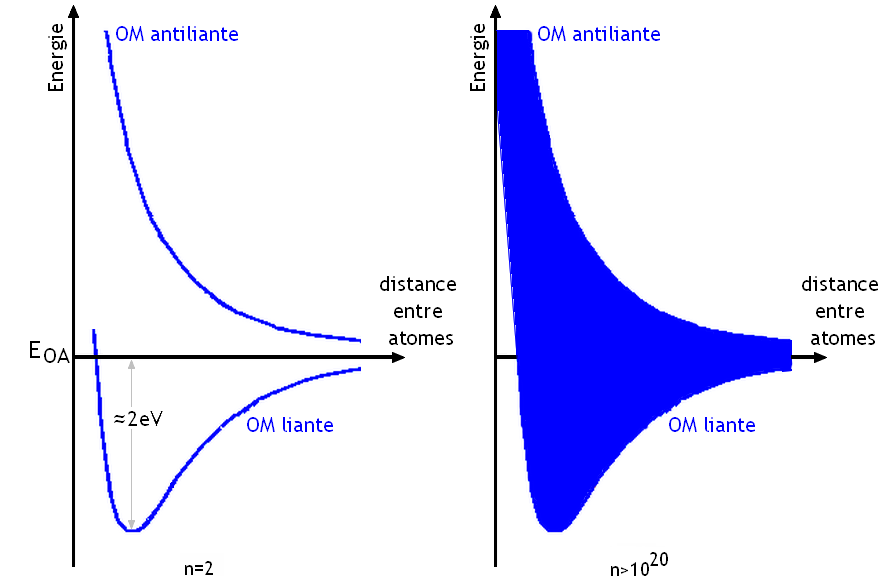
La bande possède alors une hauteur de ±2eV environ autour de la valeur de l'énergie des orbitales atomiques d'origine.
Chaque orbitale atomique 3s du sodium contient 1 électron. La bande obtenue par recouvrement de n orbitales 3s contient n orbitales moléculaires qui peuvent contenir chacune deux électrons. Dans le sodium, la bande est donc remplie à moitié (n électrons sur les 2n possibles):
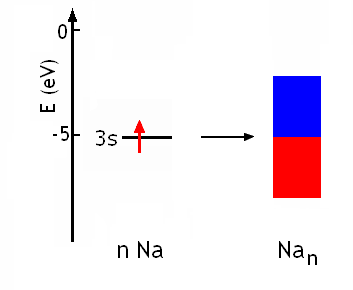
La formation de l'état Nan, l'état métal,est favorisée du point de vue de l'énergie, puisque globalement les n électrons des n atomes ont une énergie moyenne égale à l'énergie à mi-hauteur de la partie pleine de la bande, inférieure à l'énergie des orbitales atomiques:
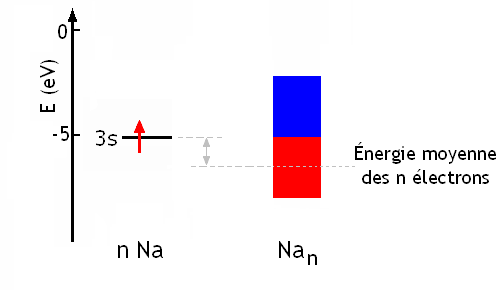
Par définition, les électrons de plus haute énergie dans la bande sont sur ce que l'on appelle le niveau de Fermi. C'est l'existence de niveaux d'énergie libre juste au dessus du niveau de Fermi qui permettra d'expliquer les propriétés générales des métaux.
Combien général est le modèleillustré avec le sodium (Z=11)? Peut-on par exemple l'appliquer au magnésium Mg (Z=12; 1s2 2s2 2p6 3s2) par exemple? Le recouvrement de n orbitales atomiques 3s de Mg (énergie = -7.6 eV), contenant chacune 2 électrons conduit à une bande continue d'environ -9 à -5 eV, contenant n orbitales moléculaires qui peuvent accomoder 2n électrons. La bande est donc pleine:
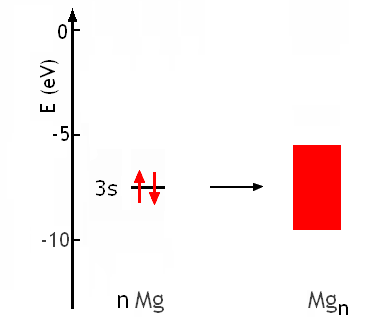
Il semble à première vue que Mg ne peut pas former un état métallique. Cependant, il faut aussi considérer le recouvrement des orbitales atomiques 3p. On ne trouve pas l'énergie de 3p de Mg dans le Tableau, mais on peut aisément l'estimer autour de -4eV, à partir de la tendance observée pour Al (Z=13; E3p≈-6.0eV), Si (Z=14; E3p≈-8.1eV), P (Z=15; E3p≈-10.5eV). Ces 3n orbitales atomiques conduisent à une bande continue de 3n orbitales moléculaires d'environ -2 à -6 eV, qui est vide mais pourrait accomoder 6n électrons:
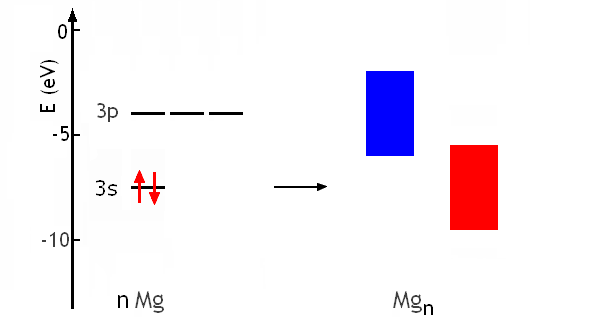
Les électrons de plus haute énergie dans la bande provenant des 3s peuvent trouver des états de moindre énergie dans la bande provenant des 3p. Le magnésium est donc bien un métal, dans lequel il existe des niveaux d'énergie libre juste au dessus du niveau de Fermi:
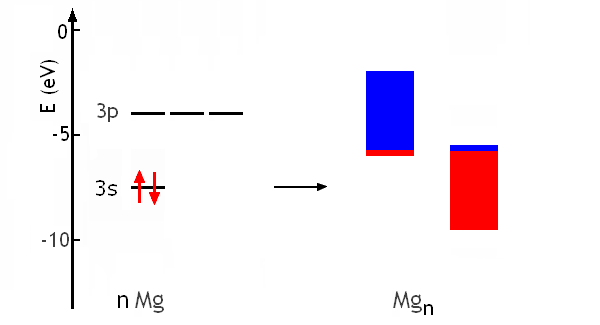
Pn peut de la même façon construire les diagrammes d'énergie de l'aluminium métallique ou du phosphore métallique. Cependant, tous les éléments ne sont pas des métaux. Pourquoi l'Argon Ar (Z=18; couche de valence 3s2 3p6) ne forme-t-il pas un solide métallique? La raison est dans la distance croissante entre niveaux d'énergie permis dans l'atome lorsqu'on se déplace de gauche à droite dans une période. Les bandes qui se formeraient par recouvrement des orbitales atomiques ne se superposent plus du tout; il existe une distance entre elles, un «gap». Par exemple, pour l'argon, E3s=-29.2eV; E3p=-15.8eV et E4s)≈-4eV (par extrapolation de E4s vs Z). Le diagramme d'énergie de l'argon métallique serait donc:
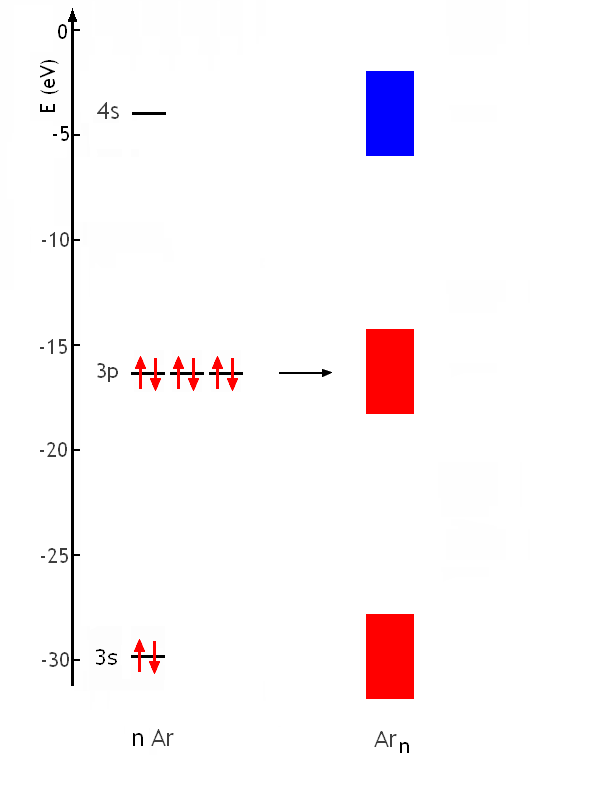
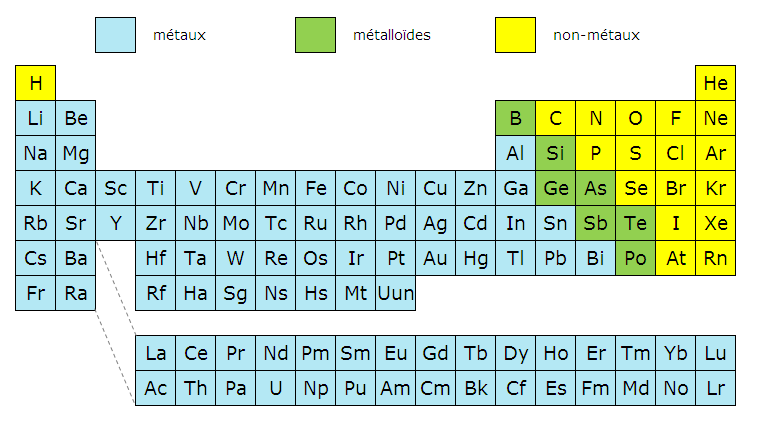
L'énergie totale n'est pas inférieure à l'énergie de l'atome isolé. Une partie seulement des éléments est un métal à l'état stable:
Bandes et propriétés des métaux
Dans les métaux, il existe des niveaux d'énergie vacants à des valeurs à peine supérieures au niveau de Fermi. Les électrons au niveau de Fermi peuvent être très facilement excités (par une différence de potentiel électrique ou un chauffage) vers un niveau supérieur, libérant un trou que peut combler un électron d'un atome voisin. On explique ainsi la grande conductibilité électrique et thermique des métaux.
Le modèle des bandes de conduction explique aussi les propriétés optiques des métaux. Les électrons au niveau de Ferni peuvent absorber tout photon de la lumière visible (400 < λ < 700 nm, soient 3.1 > hν > 1.8 eV), puis le réemettre dans la direction incidente. On explique ainsi l'aspect lustré des métaux et leur opacité complète, même à faible épaisseur.
La cohésion entre les atomes de métal est très élevée. D'une certaine façon, on peut considérer l'état métallique comme des atomes dans une mer continue d'électrons. Le métal est très facilement déformable et malléable, car tout déplacement d'un atome par rapport aux autres conduit à un réarrangement des électrons, qui sont très mobiles puisque délocalisés dans une bande d'orbitales couvrant le matériau entier. On explique ainsi la grande ductilité des métaux, qui peuvent être déformés (étirés ou pressés en feuilles) sans briser.

![]()











