Forces de van der Waals
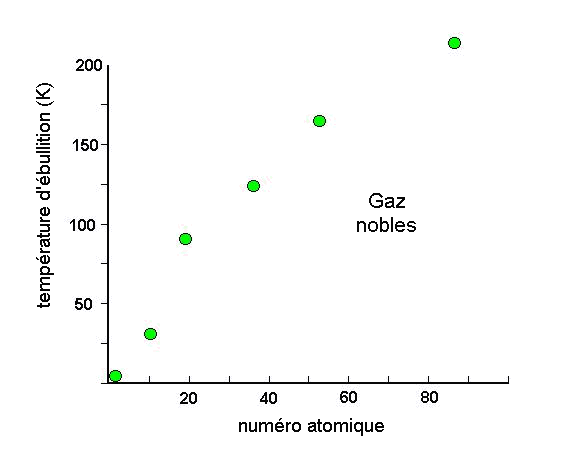
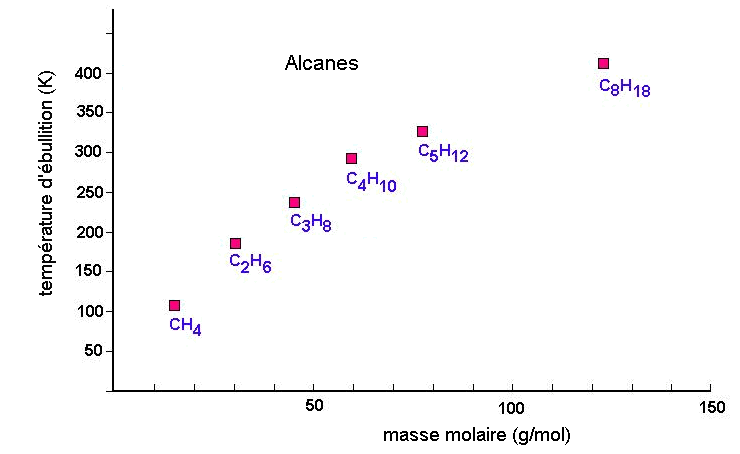
Lorsqu'on refroidit une collection de molécules à l'état gazeux, il existe une température à laquelle le milieu devient liquide, puis si on refroidit encore, solide. Comment expliquer cela pour des atomes ou des molécules non-polaires comme les gaz nobles ou les alcanes? Quelles sont les forces intermoléculaires à l'origine de ce comportement?
Ce sont les propriétés électriques des molécules qui sont à l'origine des forces intermoléculaires. Tout atome, et donc toute molécule est polarisable; Cette polarisabilité des atomes donne naissance à des attractions dipole induit - dipole induit. Si la molécule possède un moment dipolaire, des attractions dipole permanent - dipole induit et dipole permanent - dipole permanent s'y ajoutent. L'ensemble de ces interactions constituent les forces de Van der Waals.
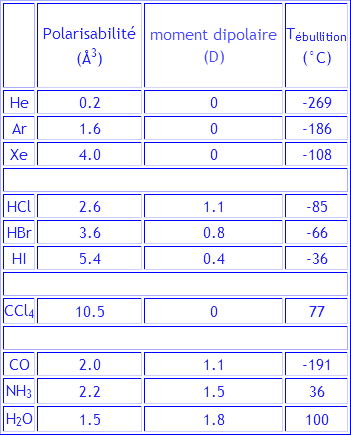
Dans le tableau ci-dessus, l'eau est une anomalie. Sa température de vaporisation est plus élevée que ne le laissent prédire son moment dipolaire et sa polarisabilité. Comment l'explique-t-on?

![]()