Énergie des orbitales dans les atomes neutres: prédictions du modèle
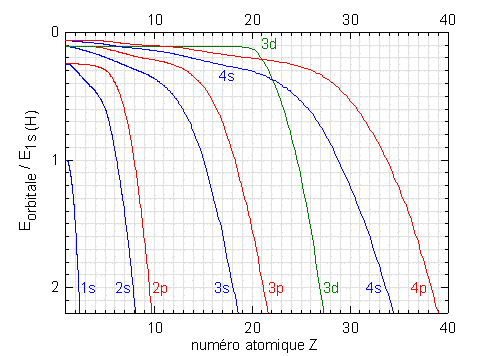
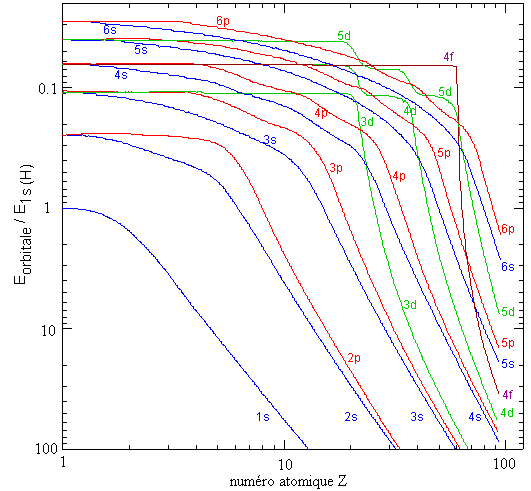
Les figures suivantes présentent l'énergie des orbitales, Eorbitale, dans les atomes neutres, en fonction du numéro atomique, Z. Ces valeurs sont le résultat de calculs de mécanique ondulatoire par une méthode approximative (R. Latter, Physical Review 1955 99, 510).
Les énergies sont représentées sur une échelle relative, Eorbitale/E1s(H) où E1s(H) est l'énergie de l'orbitale 1s de l'atome d'hydrogène, soit -13.59 eV. Par exemple, pour Z=18 (c'est-à-dire pour l'argon) E3s/E1s(H) est égal à 2; l'énergie de l'orbitale 3s de l'argon est donc environ -27.2 eV.
La première figure présente les énergies des orbitales remplies des éléments des 4 premières périodes du tableau périodique (de l'hydrogène au krypton).
La seconde figure présente, sur des échelles logarithmiques de Z et d'énergie, les énergies des orbitales remplies des éléments des 6 premières périodes du tableau périodique (de l'hydrogène au radon, en passant par les lanthanides).
 Exercices interactifs sur l'utilisation de ces figures
Exercices interactifs sur l'utilisation de ces figures
 Pour télécharger, en format PDF, la figure des énergies des orbitales des :
Pour télécharger, en format PDF, la figure des énergies des orbitales des :
Énergie des orbitales dans les atomes neutres: observations expérimentales
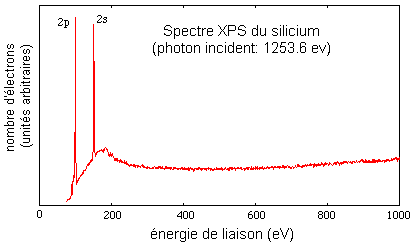
On peut vérifier expérimentalement la validité des ces prédictions par spectroscopie photoélectronique des rayons-X (XPS). La mesure consiste à irradier un atome avec un photon d'énergie connue. Si l'énergie du photon est supérieure à l'énergie de liaison d'un électron de l'atome, cet électron (appelé photoélectron) sera arraché. C'est un phénomène tout-à-fait analogue à l'effet photoélectrique, mais les énergies utilisées sont plus élevées, ce qui permet d'arracher n'importe quel électron.
Le bilan énergétique du processus est:
(énergie du photon incident) = (énergie de liaison de l'électron dans l'atome) + (énergie cinétique de l'électron arraché).
Exemple:
Si on irradie un échantillon de silicium avec des photons d'énergie égale à 1253.6 eV, on détecte deux groupes de photoélectrons, un d'énergie cinétique égale à environ 1150 eV et l'autre, environ 1100 eV. On en déduit que l'énergie de liaison de ces électrons est de 104 et 154 eV. L'énergie des orbitales qu'ils occupaient dans l'atome est donc -104 eV et -154 eV. c'est en bon accord avec les énergies prédites pour les orbitales 2s et 2p du silicium.
 pour voir le tableau des énergies des orbitales déterminées expérimentalement.
pour voir le tableau des énergies des orbitales déterminées expérimentalement.


 Exercices interactifs sur l'utilisation de ces figures
Exercices interactifs sur l'utilisation de ces figures
![]() pour voir le tableau des énergies des orbitales déterminées expérimentalement.
pour voir le tableau des énergies des orbitales déterminées expérimentalement.