
La configuration électronique spécifie le mode de remplissage d'orbitales dans un modèle des électrons indépendants donné. Dans le cas des atomes à plusieurs électrons, on peut raisonnablement concevoir que les orbitales sont des fonctions propres d'un hamiltonien effectif monoélectronique dans lequel la répulsion entre électrons ne fait que causer, en moyenne, un effet d'écran vis à vis la charge nucléaire. Tout se passerait comme si la charge nucléaire sentie n'est pas +Ze mais
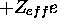 où
où

est un nombre de charge effective et 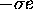 est la charge négative d'écran totale contribuée par tous les électrons autres que celui en considération. Slater avait proposé un ensemble de règles empiriques pour établir
est la charge négative d'écran totale contribuée par tous les électrons autres que celui en considération. Slater avait proposé un ensemble de règles empiriques pour établir 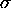 . Ces règles sont données au tableau 4.1.
. Ces règles sont données au tableau 4.1.

Table: Règles de Slater pour établir la contribution de chaque électron occuppant une orbitale 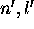 , à la charge d'écran
, à la charge d'écran 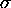 vue par un électron dans une sous-couche de nombres quantiques n,l
vue par un électron dans une sous-couche de nombres quantiques n,l
Dans ce modèle simple, qu'on appelera modèle de l'effet écran, comme dans les modèles plus exacts, tel que celui inhérent dans la méthode dite du champ auto-cohérent (Self-Consistent Field, SCF), qui, poussée à la limite exacte, donne la description de Hartree-Fock, le potentiel effectif pour chaque électron reste de symétrie sphérique. Cela signifie que, dans tous les cas, les orbitales auront la même forme analytique que celles d'un atome hydrogénoïde. On peut ainsi continuer à parler d'orbitales s, p, d, f, etc.
La principale différence avec
le cas de l'atome hydrogénoïde est le fait que l'énergie des
orbitales dans un atome à plusieurs électrons dépend non seulement
du nombre quantique principal n, mais aussi du nombre quantique
azimutal l. En règle générale, pour une valeur donnée de n,
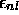 croît avec l.
Comme les niveaux deviennent de plus en plus denses au fur et à
mesure que n croît, à partir de n = 3, on voit apparaitre certaines
intrications des sous-couches énergétiques, et le niveau
croît avec l.
Comme les niveaux deviennent de plus en plus denses au fur et à
mesure que n croît, à partir de n = 3, on voit apparaitre certaines
intrications des sous-couches énergétiques, et le niveau 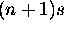 peut
devenir inférieur au niveau nd. La figure
peut
devenir inférieur au niveau nd. La figure ![]() montre clairement ces intrications: on notera surtout que, l'énergie des orbitales s et p décroit de façon monotone avec Z, tandis que celle des orbitales d et f subit des variations plus complexes quand Z augmente, croisant les courbes représentatives de l'énergie des orbitales s et p des couches supérieures. Le modèle de l'effet d'écran s'avère fort utile pour la rationalisation de ces observations:
montre clairement ces intrications: on notera surtout que, l'énergie des orbitales s et p décroit de façon monotone avec Z, tandis que celle des orbitales d et f subit des variations plus complexes quand Z augmente, croisant les courbes représentatives de l'énergie des orbitales s et p des couches supérieures. Le modèle de l'effet d'écran s'avère fort utile pour la rationalisation de ces observations:
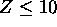 pour 3d), durant le remplissage des sous-couches inférieures. Ceci s'explique par le fait que l'orbitale nd pénètre encore moins les couches internes proches du noyau et un électron, s'il s'y trouve, verra le noyau fortement écranté; chaque fois que Z augmente d'une unité, l'électron ajouté à une sous-couche inférieure produira un écran maximal équivalent à une charge négative unitaire.
pour 3d), durant le remplissage des sous-couches inférieures. Ceci s'explique par le fait que l'orbitale nd pénètre encore moins les couches internes proches du noyau et un électron, s'il s'y trouve, verra le noyau fortement écranté; chaque fois que Z augmente d'une unité, l'électron ajouté à une sous-couche inférieure produira un écran maximal équivalent à une charge négative unitaire.
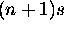 décroit plus fortement et croise nécessairement celle de l'orbitale nd. Dans le cas n = 3, l'orbitale 4s est plus profonde que l'orbitale 3d entre Z=15 (où 3p est en train de se remplir) et Z=20 (où 4s se remplit).
décroit plus fortement et croise nécessairement celle de l'orbitale nd. Dans le cas n = 3, l'orbitale 4s est plus profonde que l'orbitale 3d entre Z=15 (où 3p est en train de se remplir) et Z=20 (où 4s se remplit).
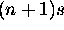 se remplit, l'ordre des 2 niveaux
se remplit, l'ordre des 2 niveaux 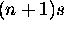 et nd tend à s'inverser une seconde fois.
Comme
et nd tend à s'inverser une seconde fois.
Comme 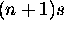 est plus diffuse et plus étalée, l'orbitale nd la recoupe bien, et voit un effet d'écran moins efficace de la part des deux électrons
est plus diffuse et plus étalée, l'orbitale nd la recoupe bien, et voit un effet d'écran moins efficace de la part des deux électrons 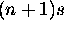 (les règles de Slater ne prévoient pas ce cas). Pour un électron de test dans l'orbitale nd, la charge nucléaire effective semble donc augmenter, et l'énergie de nd chute pour redevenir plus basse que celle de
(les règles de Slater ne prévoient pas ce cas). Pour un électron de test dans l'orbitale nd, la charge nucléaire effective semble donc augmenter, et l'énergie de nd chute pour redevenir plus basse que celle de 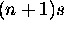 .
.
Le remplissage des niveaux
orbitalaires se fait en respectant le principe de Pauli et l'ordre des
niveaux d'énergie orbitalaire, comme on peut le lire sur la figure ![]() . Cet ordre semble suivre la
règle simple suivante: l'énergie orbitalaire
. Cet ordre semble suivre la
règle simple suivante: l'énergie orbitalaire 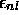 croît
avec la somme n+l des nombres quantiques principal et azimutal, et à
valeurs égales de n+l, elle croît avec n. Cette règle est
schématisée à la figure 4.1.
croît
avec la somme n+l des nombres quantiques principal et azimutal, et à
valeurs égales de n+l, elle croît avec n. Cette règle est
schématisée à la figure 4.1.
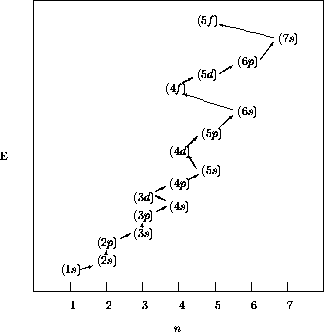
Figure 4.1: Ordre des énergies orbitalaires dans un atome à plusieurs
électrons
Le tableau 4.2 donne la configuration de l'état fondamental des éléments allant de l'Hydrogène au Krypton; la mention [gaz rare] dénote la configuration à couches complètes de l'élément gaz rare précédant l'élément en considération. Quelques cas spéciaux méritent qu'on y prête une attention particulière:
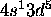 et non [Ar]
et non [Ar]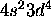 . Les 6 électrons se placent de sorte à donner deux sous-couches à moitié remplies. Cette disposition permet d'avoir le plus grand nombre de spins électroniques parallèles, qui par le principe d'exclusion de Pauli, ont tendance à s'éloigner le plus que possible, minimisant ainsi, en moyenne, l'énergie potentielle de répulsion électronique. Ce gain d'énergie est suffisant pour compenser l'énergie de promotion pour faire passer un électron du niveau 4s au niveau 3d, vue la proximité de ces deux niveaux au voisinage de Z = 25. Le même effet se manifeste dans le cas de Nb ([Kr]
. Les 6 électrons se placent de sorte à donner deux sous-couches à moitié remplies. Cette disposition permet d'avoir le plus grand nombre de spins électroniques parallèles, qui par le principe d'exclusion de Pauli, ont tendance à s'éloigner le plus que possible, minimisant ainsi, en moyenne, l'énergie potentielle de répulsion électronique. Ce gain d'énergie est suffisant pour compenser l'énergie de promotion pour faire passer un électron du niveau 4s au niveau 3d, vue la proximité de ces deux niveaux au voisinage de Z = 25. Le même effet se manifeste dans le cas de Nb ([Kr]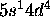 ), Mo ([Kr]
), Mo ([Kr]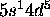 ), et quelques autres cas du bloc f.
), et quelques autres cas du bloc f.
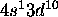 . Cet élément se situe au delà du second point de croisement entre les courbes représentatives de l'énergie des orbitales 3d et 4s en fonction de Z, et le niveau 3d est plus profond que le niveau 4s. De plus, la sous-couche nd étant alors complètement remplie, la configuration a une stabilité particulière. De même, la configuration de Ag est [Kr]
. Cet élément se situe au delà du second point de croisement entre les courbes représentatives de l'énergie des orbitales 3d et 4s en fonction de Z, et le niveau 3d est plus profond que le niveau 4s. De plus, la sous-couche nd étant alors complètement remplie, la configuration a une stabilité particulière. De même, la configuration de Ag est [Kr]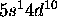 , celle de Au, [Xe]
, celle de Au, [Xe]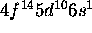 .
.

Table 4.2: configuration de l'état fondamental
des éléments allant de l'Hydrogène au Krypton