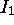 d'un atome X par
d'un atome X par

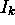 par
par

On définit
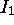 d'un atome X par
d'un atome X par

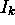 par
par

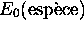 indique l'énergie de l'état fondamental de l'espèce en considération.
indique l'énergie de l'état fondamental de l'espèce en considération.
En principe, les énergies orbitalaires dépendent de l'état électronique de l'espèce. Comme l'état ionisé  peut être considéré comme juste l'un des états électroniques de X, parmi tant d'autres, les orbitales de l'ion
peut être considéré comme juste l'un des états électroniques de X, parmi tant d'autres, les orbitales de l'ion 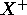 sont différentes de celles de l'atome neutre X. Cependant, dans une très bonne approximation, dite approximation de Koopman,
sont différentes de celles de l'atome neutre X. Cependant, dans une très bonne approximation, dite approximation de Koopman, 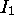 peut être représenté par l'énergie (
peut être représenté par l'énergie (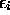 ) de l'orbitale (
) de l'orbitale (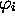 ) où résidait, dans l'atome parent X, l'électron éjecté
) où résidait, dans l'atome parent X, l'électron éjecté

Dans ce sens, l'étude du premier potentiel d'ionisation des éléments est utile, car elle constitue une sonde expérimentale de la structure orbitalaire des atomes. De même, l'étude des autres potentiels d'ionisation des éléments, dans la mesure où ils sont définissables, fournit une sonde de la structure orbitalaire des cations. On s'intéresse ici à la structure des éléments, donc particulièrement à leur premier potentiel d'ionisation.
Les figures 4.2, 4.3 montrent les variations de 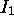 sur la 2ième période et sur la 4ième période du tableau périodique, respectivement, tandis que les variations dans un groupe (une famille) du tableau périodique sont illustrées à la figure 4.4 pour le groupe des alcalins (groupe Ia ou groupe 1) et à la figure 4.5 pour la famille du Bore (groupe IIIa ou groupe ). La figure 4.6 donne un aperçu général des variations du premier potentiel d'ionisation en fonction du nombre atomique Z.
sur la 2ième période et sur la 4ième période du tableau périodique, respectivement, tandis que les variations dans un groupe (une famille) du tableau périodique sont illustrées à la figure 4.4 pour le groupe des alcalins (groupe Ia ou groupe 1) et à la figure 4.5 pour la famille du Bore (groupe IIIa ou groupe ). La figure 4.6 donne un aperçu général des variations du premier potentiel d'ionisation en fonction du nombre atomique Z.
Figure 4.2: Variation de 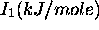 sur la deuxième période
sur la deuxième période
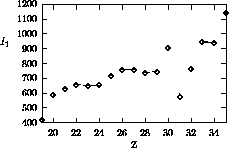
Figure 4.3: Variation de 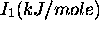 sur la quatrième période
sur la quatrième période
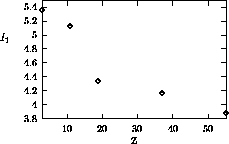
Figure 4.4: Variation de 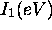 dans le groupe IA
dans le groupe IA
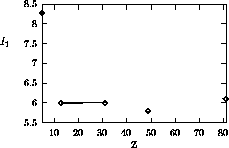
Figure 4.5: Variation de 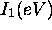 dans le groupe IIIA
dans le groupe IIIA
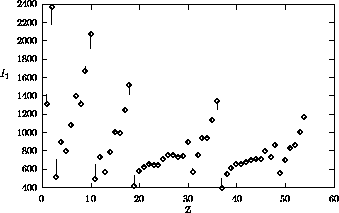
Figure 4.6: Variation de 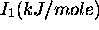 sur les cinq premières périodes
sur les cinq premières périodes
On constate que
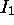 atteint son maximum absolu sur une période quand l'on arrive au groupe des gaz rares, avant de chuter dramatiquement quand l'on passe à l'élément alcalin suivant, donnant ainsi lieu à la périodicité globale illustrée à la figure 4.6. La configuration des gaz rares en est une à couche complète, elle est d'une stabilité particulière.
atteint son maximum absolu sur une période quand l'on arrive au groupe des gaz rares, avant de chuter dramatiquement quand l'on passe à l'élément alcalin suivant, donnant ainsi lieu à la périodicité globale illustrée à la figure 4.6. La configuration des gaz rares en est une à couche complète, elle est d'une stabilité particulière.
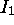 tend à décroître quand l'on descend un groupe donné: ceci est relié au fait que plus bas un élément se situe dans un groupe, plus l'orbitale périphérique (ou se trouvait l'électron éjecté) est diffuse, possédant un nombre quantique principal plus grand, et moins elle est profonde en énergie.
tend à décroître quand l'on descend un groupe donné: ceci est relié au fait que plus bas un élément se situe dans un groupe, plus l'orbitale périphérique (ou se trouvait l'électron éjecté) est diffuse, possédant un nombre quantique principal plus grand, et moins elle est profonde en énergie.
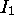 croît généralement quand l'on traverse une période. Mais cette variation est loin d'être monotone:
croît généralement quand l'on traverse une période. Mais cette variation est loin d'être monotone:
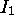 atteint un maximum local
atteint un maximum local
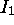 augmente.
augmente.
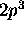 dénote une sous-couche à demi remplie. Les trois électrons 2p ont leur spin parallèle, et cette configuration est celle avec le nombre maximale de spins électroniques non-appariés qui soit possible dans une sous-couche np. Ceci confère une stabilité maximale à l'état fondamental de l'azote. Quand l'on continue d'ajouter des électrons à la sous-couche 2p l'énergie de répulsion électronique augmente, et
dénote une sous-couche à demi remplie. Les trois électrons 2p ont leur spin parallèle, et cette configuration est celle avec le nombre maximale de spins électroniques non-appariés qui soit possible dans une sous-couche np. Ceci confère une stabilité maximale à l'état fondamental de l'azote. Quand l'on continue d'ajouter des électrons à la sous-couche 2p l'énergie de répulsion électronique augmente, et 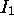 diminue de N à O.
L'augmentation de la charge nucléaire effective n'est suffisamment efficace pour contrer celle de la répulsion électronique qu'à partir de O et
diminue de N à O.
L'augmentation de la charge nucléaire effective n'est suffisamment efficace pour contrer celle de la répulsion électronique qu'à partir de O et 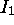 remonte à partir de ce point.
remonte à partir de ce point.
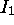 atteint un maximum pour As pour les mêmes raisons qu'avancées ci-haut pour N. Le maximum observé pour Zn accompagne l'atteinte de la configuration à sous-couches complètes
atteint un maximum pour As pour les mêmes raisons qu'avancées ci-haut pour N. Le maximum observé pour Zn accompagne l'atteinte de la configuration à sous-couches complètes 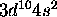 . L'électron éjecté étant un des électrons 4s, ce maximum s'explique par le même raisonnement que celui employé ci-haut pour Be.
. L'électron éjecté étant un des électrons 4s, ce maximum s'explique par le même raisonnement que celui employé ci-haut pour Be.
Une propriété qui n'est pas sans rappeller le premier potentiel d'ionisation est l' affinité électronique. C'est l'énergie qui accompagne la capture d'un électron par un élément X pour former l'anion
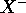 :
:

On voit que 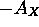 n'est rien d'autre que le premier potentiel d'ionisation de l'anion
n'est rien d'autre que le premier potentiel d'ionisation de l'anion 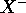 : l'anion
: l'anion 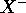 est stable quand
est stable quand 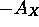 est positive, donc quand
est positive, donc quand 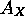 est négative. Tout comme le premier potentiel d'ionisation qui donne une idée de la position de l'orbitale périphérique, par le théorème de Koopman, l'affinité électronique est reliée approximativement à l'énergie de la première orbitale vacante de l'élément. Le tableau 4.3 montre les valeurs de
est négative. Tout comme le premier potentiel d'ionisation qui donne une idée de la position de l'orbitale périphérique, par le théorème de Koopman, l'affinité électronique est reliée approximativement à l'énergie de la première orbitale vacante de l'élément. Le tableau 4.3 montre les valeurs de 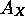 des éléments.
des éléments.
Table 4.3: Affinité électronique (en 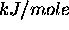 ) des éléments selon Zollweg
) des éléments selon Zollweg
La plupart des éléments ont une 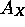 négative. Les halogènes sont caractérisés par des valeurs les plus négatives de
négative. Les halogènes sont caractérisés par des valeurs les plus négatives de 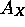 tandis que leurs voisins immédiats à la droite du tableau périodique, les gaz rares, ont tous une affinité électronique positive. Ceci reflète la stabilité particulière de la configuration à couches complètes des gaz rares. Pareillement,
tandis que leurs voisins immédiats à la droite du tableau périodique, les gaz rares, ont tous une affinité électronique positive. Ceci reflète la stabilité particulière de la configuration à couches complètes des gaz rares. Pareillement, 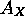 augmente (devient moins négative)
augmente (devient moins négative)
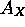 positive,
positive,
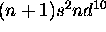 ,
,
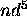 ,
,
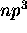 .
.