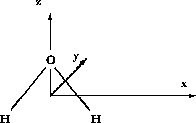
Figure 5.14: Système de coordonnées utilisé dans la définition des orbitales atomiques de

Figure 5.14: Système de coordonnées utilisé dans la définition des orbitales
atomiques de 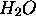
On considérera ici cette molécule plane dans le système de coordonnées de la figure 5.14, où tous les noyaux se trouvent dans le plan xz, et l'axe de symétrie du système coincide avec l'axe des z. La base minimale des orbitales atomiques est constituée
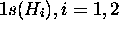 , des deux hydrogènes,
, des deux hydrogènes,
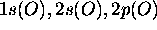 pour l'oxygène.
pour l'oxygène.
Comme dans le cas précédent on s'attend à ce que l'orbitale
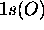 reste pratiquement inchangée, et devient simplement une
orbitale de coeur non-liante de la molécule. L'orbitale
reste pratiquement inchangée, et devient simplement une
orbitale de coeur non-liante de la molécule. L'orbitale 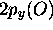 de
l'oxygène ne se recouvrant pas avec les orbitales
de
l'oxygène ne se recouvrant pas avec les orbitales 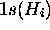 , elle
devient aussi une orbitale non-liante. Seules les orbitales
, elle
devient aussi une orbitale non-liante. Seules les orbitales
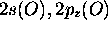 et
et 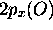 peuvent se combiner avec les deux
peuvent se combiner avec les deux 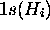 .
La symétrie du système impose le remplacement de ces deux
orbitales hydrogénoïdes par les combinaisons linéaires adaptées à la
symétrie suivantes:
.
La symétrie du système impose le remplacement de ces deux
orbitales hydrogénoïdes par les combinaisons linéaires adaptées à la
symétrie suivantes:
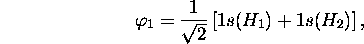
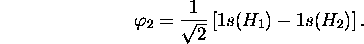
De ces deux fonctions 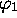 est de même type de symétrie (type dite
est de même type de symétrie (type dite
 que
que 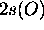 et
et 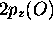 . Ces trois fonctions se combinent pour
donner trois orbitales moléculaires du type
. Ces trois fonctions se combinent pour
donner trois orbitales moléculaires du type 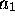
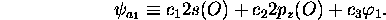
En supposant 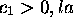 première orbitale
première orbitale 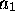 est caractérisée par
est caractérisée par
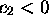 et
et 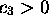 . C'est une orbitale fortement liante, et son
énergie est telle qu'elle est la plus profonde des orbitales moléculaires de
valence considérées. L'orbitale
. C'est une orbitale fortement liante, et son
énergie est telle qu'elle est la plus profonde des orbitales moléculaires de
valence considérées. L'orbitale 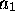 de plus haute énergie est
caractérisée par
de plus haute énergie est
caractérisée par 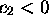 et
et 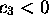 . Elle est fortement antiliante. La
dernière orbitale du type
. Elle est fortement antiliante. La
dernière orbitale du type 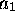 est non-liante; son occupation
complète, avec celle de l'orbitale non-liante
est non-liante; son occupation
complète, avec celle de l'orbitale non-liante 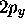 , permet
d'écrire la molécule avec deux paires d'électrons 'libres'.
, permet
d'écrire la molécule avec deux paires d'électrons 'libres'.
La deuxième combinaisons linéaires des orbitales 1s
hydrogénoïdes, 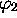 , est de même symétrie que
, est de même symétrie que 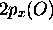 (symétrie
(symétrie 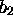 ); leur combinaison linéaire donne deux
orbitales moléculaires du type
); leur combinaison linéaire donne deux
orbitales moléculaires du type 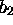
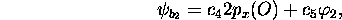
dont l'une est liante , l'autre antiliante.
La figure 5.15 montre les niveaux d'énergies
orbitalaires de  , ainsi que leur schéma d'occupation par les
électrons de valence de la molécule. On y trouve aussi, pour fins
de comparaison, les niveaux des orbitales correspondantes pour la
molécule linéaire
, ainsi que leur schéma d'occupation par les
électrons de valence de la molécule. On y trouve aussi, pour fins
de comparaison, les niveaux des orbitales correspondantes pour la
molécule linéaire  qui compte quatre électrons de moins
que
qui compte quatre électrons de moins
que 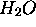 .
.
Pour ce cas, il suffit de remplacer les orbitales de l'oxygène du cas précédent par celles de Be. La base minimale est donc constituée
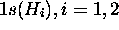 , des deux hydrogènes,
, des deux hydrogènes,
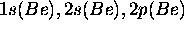 pour l'oxygène.
pour l'oxygène.
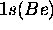 reste une orbitale de coeur tandis que, compte tenu de la linéarité de
reste une orbitale de coeur tandis que, compte tenu de la linéarité de 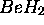 , les orbitales de valence seront formées par combinaison de
, les orbitales de valence seront formées par combinaison de 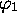 avec
avec 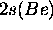 et de
et de 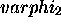 avec
avec 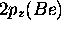 , Les orbitales
, Les orbitales 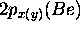 resteront inchangées et sont des OM non-liantes. On a donc:
resteront inchangées et sont des OM non-liantes. On a donc:
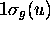 (anti)liante:
(anti)liante:
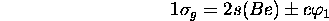
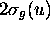 (anti)liante:
(anti)liante:
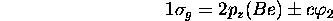
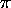 , nonliantes, les
, nonliantes, les 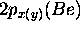 .
.
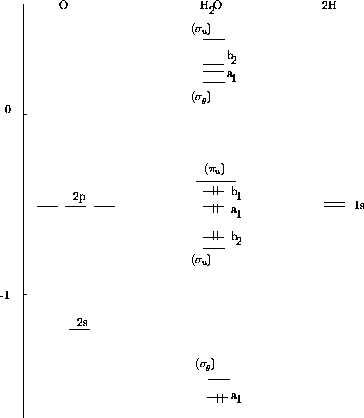
Figure: Niveaux d'énergies orbitalaires de  , ainsi que leur
schéma d'occupation par les électrons de valence de la molécule. On montre aussi, en tirets,
les niveaux des orbitales correspondantes pour
, ainsi que leur
schéma d'occupation par les électrons de valence de la molécule. On montre aussi, en tirets,
les niveaux des orbitales correspondantes pour