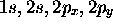 et
et 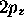 pour le fluor.
pour le fluor.
Les dix électrons de la molécule HF nous obligent à construire au moins cinq orbitales moléculaires pour les décrire. Dans la description la plus simple, utilisant une base d'orbitales atomiques appelée base minimale, on ne retiendrait que les orbitales atomiques occupées dans les éléments, c'est-à-dire
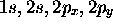 et
et 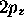 pour le fluor.
pour le fluor.
Les combinaisons linéaires d'orbitales atomiques centrées sur les
deux atomes font donc appel à l'orbitale 1s de l'hydrogène. Si
l'on définit l'axe z comme étant l'axe internucléaire de la
molécule, alors 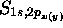 est nulle, et les orbitales
est nulle, et les orbitales 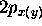 du
fluor ne se mélangerait jamais avec l'orbitale 1s de l'hydrogène.
Elles resteront inchangées, et deviennent des orbitales
moléculaires dites non-liantes. Il reste donc pour le fluor trois
orbitales susceptibles de se combiner avec l'orbitale 1s de
l'hydrogène, soit les orbitales 1s, 2s et
du
fluor ne se mélangerait jamais avec l'orbitale 1s de l'hydrogène.
Elles resteront inchangées, et deviennent des orbitales
moléculaires dites non-liantes. Il reste donc pour le fluor trois
orbitales susceptibles de se combiner avec l'orbitale 1s de
l'hydrogène, soit les orbitales 1s, 2s et 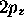 . Examinons leur
énergie en comparaison avec l'énergie de l'orbitale 1s de
l'hydrogène (-0,5 u.a.); on estime que
. Examinons leur
énergie en comparaison avec l'énergie de l'orbitale 1s de
l'hydrogène (-0,5 u.a.); on estime que
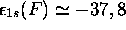 u.a.,
u.a.,
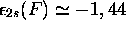 u.a.,
u.a.,
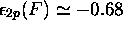 u.a.
u.a.
À cause de sa disposition énergétique bien plus profonde,
l'orbitale 1s du fluor ne se mélangerait pratiquement pas avec
l'orbitale 1s de l'hydrogène. Même l'orbitale 2s du fluor ne se
mélangerait que faiblement avec l'orbitale 1s de l'hydrogène. Il
ne reste donc que l'orbitale 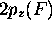 qui peut se combiner de façon
appréciable avec l'orbitale 1s de l'hydrogène. On peut donc
établir que, qualitativement, les six premières orbitales
moléculaires de HF seront, dans l'ordre d'énergie croissante:
qui peut se combiner de façon
appréciable avec l'orbitale 1s de l'hydrogène. On peut donc
établir que, qualitativement, les six premières orbitales
moléculaires de HF seront, dans l'ordre d'énergie croissante:
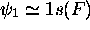 avec
avec 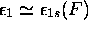 , orbitale non-liante,
, orbitale non-liante,
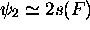 avec
avec 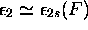 , orbitale non-liante,
, orbitale non-liante,
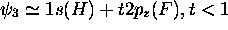 , avec
, avec 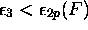 , orbitale liante,
, orbitale liante,
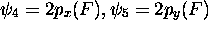 , avec
, avec 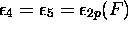 , niveau doublement
dégénéré. Ce sont des orbitales non-liantes,
, niveau doublement
dégénéré. Ce sont des orbitales non-liantes,
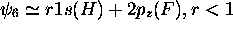 , avec
, avec 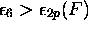 , orbitale anti-liante.
, orbitale anti-liante.
La figure 5.13 illustre ces résultats sous forme d'un diagramme de corrélation de niveaux d'énergie.
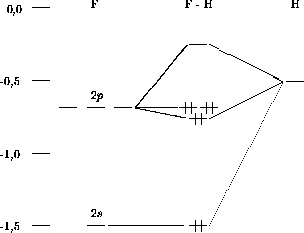
Figure 5.13: Diagramme de corrélation des niveaux d'énergie atomiques et moléculaires de HF