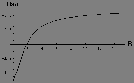
Figure: Intégrale
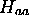 (en u.a.) en fonction de R(u.a) pour le schéma LCAO impliquant l'orbitale atomique 1s centrée sur l'une ou l'autre proton de
(en u.a.) en fonction de R(u.a) pour le schéma LCAO impliquant l'orbitale atomique 1s centrée sur l'une ou l'autre proton de 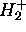 .
.
À l'état fondamental, l'électron unique de
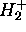 occupe une OM qui devrait se corréler asymptotiquement à l'orbitale atomique 1s d'un atome d'hydrogène isolé (infiniment éloigné d'un proton nu). On s'attend donc à ce que cette OM soit assez bien décrite par la conbinaison linéaire de deux orbitales 1s centrées chacune sur un noyau. Ceci correspond à poser
occupe une OM qui devrait se corréler asymptotiquement à l'orbitale atomique 1s d'un atome d'hydrogène isolé (infiniment éloigné d'un proton nu). On s'attend donc à ce que cette OM soit assez bien décrite par la conbinaison linéaire de deux orbitales 1s centrées chacune sur un noyau. Ceci correspond à poser 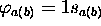 dans (5.11). On obtient alors ce qui est appelé la description de
dans (5.11). On obtient alors ce qui est appelé la description de 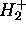 en base minimale. Dans ce cas, les intégrales
en base minimale. Dans ce cas, les intégrales 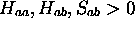 peuvent s'évaluer analytiquement. Les figures 5.3, 5.4 et 5.5 montre le comportement de ces intégrales vues comme fonctions de la distance internucléaire R.
peuvent s'évaluer analytiquement. Les figures 5.3, 5.4 et 5.5 montre le comportement de ces intégrales vues comme fonctions de la distance internucléaire R.

Figure: Intégrale 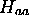 (en u.a.) en fonction de R(u.a) pour le schéma LCAO impliquant l'orbitale atomique 1s centrée sur l'une ou l'autre proton de
(en u.a.) en fonction de R(u.a) pour le schéma LCAO impliquant l'orbitale atomique 1s centrée sur l'une ou l'autre proton de 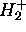 .
.

Figure: Intégrale 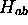 (en u.a.) en fonction de R(u.a) pour le schéma LCAO impliquant l'orbitale atomique 1s centrée sur l'une ou l'autre proton de
(en u.a.) en fonction de R(u.a) pour le schéma LCAO impliquant l'orbitale atomique 1s centrée sur l'une ou l'autre proton de 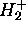 .
.
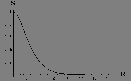
Figure: Intégrale de recouvrement 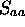 (en u.a.) en fonction de R(u.a) pour le schéma LCAO impliquant l'orbitale atomique 1s centrée sur l'une ou l'autre proton de
(en u.a.) en fonction de R(u.a) pour le schéma LCAO impliquant l'orbitale atomique 1s centrée sur l'une ou l'autre proton de 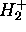 .
.
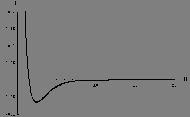
Figure: Fonctions d'énergie potentielle (en u.a.) 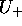 , (trait plein), et
, (trait plein), et 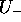 , (tirets), en fonction de R(u.a). Ces courbes d'énergie potentielle sont associées aux états
, (tirets), en fonction de R(u.a). Ces courbes d'énergie potentielle sont associées aux états 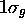 et
et 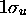 obtenus dans un traitement LCAO en base minimale de
obtenus dans un traitement LCAO en base minimale de 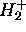 .
.
La figure 5.6 montre les courbes d'énergie potentielle pour les deux premiers états de 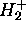 , c.à d. le graphe des fonctions
, c.à d. le graphe des fonctions
où 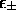 données par (5.23) et (5.24) sont les énergies purement électroniques des deux états (orbitales)
données par (5.23) et (5.24) sont les énergies purement électroniques des deux états (orbitales) 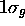 et
et 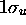 , définis par
, définis par
(on vérifiera le bien-fondé de l'appelation donnée de ces deux orbitales). L'orbitale 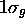 est la première OM du type
est la première OM du type 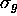 : elle est obtenue par une combinaison liante des OA
: elle est obtenue par une combinaison liante des OA 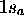 et
et 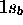 . On la désigne encore
. On la désigne encore 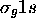 pour cette raison. Pareillement, l'orbitale antiliante
pour cette raison. Pareillement, l'orbitale antiliante 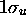 est aussi appelée
est aussi appelée 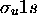 . La figure 5.7 montre une représentation photographique de l'orbitale
. La figure 5.7 montre une représentation photographique de l'orbitale 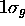 accompagnée du profil de cette orbitale le long de l'axe internucléaire. Le caractère liant de l'orbitale est clairement ressorti sur ces images. De même, on peut clairement voir le caractère antiliant de
accompagnée du profil de cette orbitale le long de l'axe internucléaire. Le caractère liant de l'orbitale est clairement ressorti sur ces images. De même, on peut clairement voir le caractère antiliant de 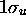 représentée de la même façon dans la figure 5.8.
représentée de la même façon dans la figure 5.8.
Figure: Représentation photographique de l'orbitale liante 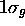 accompagnée de son profil le long de l'axe internucléaire.
accompagnée de son profil le long de l'axe internucléaire.
Figure: Représentation photographique de l'orbitale antiliante 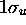 accompagnée de son profil le long de l'axe internucléaire.
accompagnée de son profil le long de l'axe internucléaire.
Par le même procédé, si l'on partait de 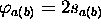 dans (5.11), correspondant à la limite dissociative où l'atome d'hydrogène dissocié serait dans l'état 2s, on aurait obtenu deux autres OM: l'une,
dans (5.11), correspondant à la limite dissociative où l'atome d'hydrogène dissocié serait dans l'état 2s, on aurait obtenu deux autres OM: l'une, 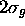 ou
ou 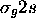 , est liante; l'autre,
, est liante; l'autre, 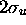 ou
ou 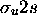 , est antiliante. La figure 5.9 montre l'orbitale liante
, est antiliante. La figure 5.9 montre l'orbitale liante 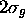 sous forme photographique et sous forme tridimensionnelle, cette dernière servant à démontrer l'effet de la surface nodale inhérente dans 2s sur la distribution dans l'orbitale moléculaire.
sous forme photographique et sous forme tridimensionnelle, cette dernière servant à démontrer l'effet de la surface nodale inhérente dans 2s sur la distribution dans l'orbitale moléculaire.
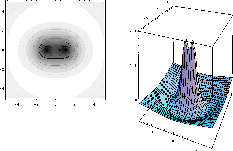
Figure: Représentation photographique de l'orbitale antiliante 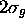 accompagnée d'une représentation 3D de l'orbitale vue dans un plan contenant l'axe internucléaire.
accompagnée d'une représentation 3D de l'orbitale vue dans un plan contenant l'axe internucléaire.
La troisième paire d'OM du type 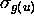 s'obtient par la combinaison linéaire des orbitales
s'obtient par la combinaison linéaire des orbitales 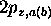 centrées sur les noyaux A et B. Dans ce cas, l'orbitale liante, montrée à la figure 5.10, est
centrées sur les noyaux A et B. Dans ce cas, l'orbitale liante, montrée à la figure 5.10, est
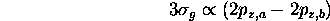
tandis que la combinaison linéaire avec la même phase entre les deux 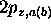 est antiliante.
est antiliante.
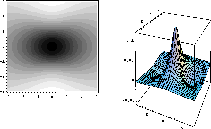
Figure: Représentation photographique de l'orbitale antiliante 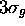 accompagnée d'une représentation 3D de l'orbitale vue dans un plan contenant l'axe internucléaire.
accompagnée d'une représentation 3D de l'orbitale vue dans un plan contenant l'axe internucléaire.
Notons que la distinction 2s vs. 2p dans le cas de 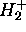 n'a pas beaucoup de sens. Ces orbitales atomiques ont en effet la même énergie, et sont donc susceptibles de se combiner fortement. Néanmoins, la discussion présente offre un intérêt dans la mesure où elle est pertinente pour la compréhension des OM d'une molécule diatomique homonucléaire du type
n'a pas beaucoup de sens. Ces orbitales atomiques ont en effet la même énergie, et sont donc susceptibles de se combiner fortement. Néanmoins, la discussion présente offre un intérêt dans la mesure où elle est pertinente pour la compréhension des OM d'une molécule diatomique homonucléaire du type 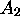 .
.
Finalement, si l'on partait de 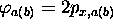 (ou
(ou 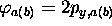 ) dans (5.11), on obtiendrait
) dans (5.11), on obtiendrait
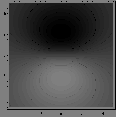
Figure: Représentation photographique de l'orbitale liante 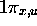 .
.
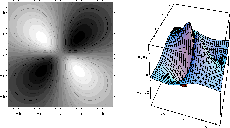
Figure: Représentation photographique de l'orbitale antiliante 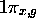 accompagnée d'une représentation 3D de l'orbitale vue dans un plan contenant l'axe internucléaire.
accompagnée d'une représentation 3D de l'orbitale vue dans un plan contenant l'axe internucléaire.