



Next: Distributions de vitesse
Up: Théorie cinétique des
Previous: Théorie cinétique des
Dans le cas des mouvements de translation pure des molécules dans un gaz, la loi de Maxwell-Boltzmann décrit aussi la distribution des vitesses de translation des molécules de gaz. La théorie cinétique des gaz étudie les conséquences de cette distribution de vitesses, en faisant abstraction complètement de la structure interne des molécules constituant le gaz. Celles-ci sont donc considérées comme des simples masses quasi-ponctuelles distribuées uniformément dans l'espace, c. à d. que la densité spatiale de gaz est 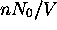 . Aucune interaction mutuelle n'est tenue compte dans la théorie cinétique des gaz. Les distributions de vitesses considérées en théorie cinétique des gaz concernent souvent la vitesse individuelle des molécules d'un gaz homogène. Dans ce cas la quantité m qu'on trouvera dans ce qui suit représenterait la masse individuelle d'une molécule du gaz. Dans l'application de la distribution de Maxwell-Boltzmann à la théorie des collisions bimoléculaires, A + B, cette distribution concerne plutôt la vitesse relative d'une molécule (partenaire de collision) par rapport à l'autre et m est la masse réduite de la paire, soit
. Aucune interaction mutuelle n'est tenue compte dans la théorie cinétique des gaz. Les distributions de vitesses considérées en théorie cinétique des gaz concernent souvent la vitesse individuelle des molécules d'un gaz homogène. Dans ce cas la quantité m qu'on trouvera dans ce qui suit représenterait la masse individuelle d'une molécule du gaz. Dans l'application de la distribution de Maxwell-Boltzmann à la théorie des collisions bimoléculaires, A + B, cette distribution concerne plutôt la vitesse relative d'une molécule (partenaire de collision) par rapport à l'autre et m est la masse réduite de la paire, soit

où 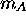 ,
,  sont les masses moléculaires de A et B respectivement.
sont les masses moléculaires de A et B respectivement.
Cours WWW Cinetique Chimique
Wed Jan 8 16:28:09 EST 2003
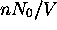 . Aucune interaction mutuelle n'est tenue compte dans la théorie cinétique des gaz. Les distributions de vitesses considérées en théorie cinétique des gaz concernent souvent la vitesse individuelle des molécules d'un gaz homogène. Dans ce cas la quantité m qu'on trouvera dans ce qui suit représenterait la masse individuelle d'une molécule du gaz. Dans l'application de la distribution de Maxwell-Boltzmann à la théorie des collisions bimoléculaires, A + B, cette distribution concerne plutôt la vitesse relative d'une molécule (partenaire de collision) par rapport à l'autre et m est la masse réduite de la paire, soit
. Aucune interaction mutuelle n'est tenue compte dans la théorie cinétique des gaz. Les distributions de vitesses considérées en théorie cinétique des gaz concernent souvent la vitesse individuelle des molécules d'un gaz homogène. Dans ce cas la quantité m qu'on trouvera dans ce qui suit représenterait la masse individuelle d'une molécule du gaz. Dans l'application de la distribution de Maxwell-Boltzmann à la théorie des collisions bimoléculaires, A + B, cette distribution concerne plutôt la vitesse relative d'une molécule (partenaire de collision) par rapport à l'autre et m est la masse réduite de la paire, soit

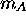 ,
,  sont les masses moléculaires de A et B respectivement.
sont les masses moléculaires de A et B respectivement.